Стехиометрия - это раздел общей химии, который занимается расчетами количественного хода химических реакций. При работе в лаборатории очень часто возникает необходимость узнать, какое количество (масса, объем, молекулы) субстратов необходимо использовать для того, чтобы проводимая нами химическая реакция прошла полностью или чтобы получить предполагаемое количество продукта. Иногда также необходимо рассчитать избыток или недостаток субстрата, который привел к тому, что эксперимент прошел не так, как ожидалось. Каждый из этих расчетов напрямую вытекает из количественной интерпретации обозначения уравнения химической реакции и использует законы сохранения массы. Такие уравнения называются стехиометрическими расчетами.

Что нам нужно знать?
Чтобы использовать стехиометрию, необходимы знания во многих областях, в том числе: уравнения химических реакций, стехиометрические коэффициенты, моли и молярные массы, молярные объемы газов и закон Авогадро. Используя знания о стехиометрии химических реакций, можно решить множество вычислительных задач, таких как:
- элементарный анализ,
- молярные расчеты,
- массовые расчеты,
- расчет нестехиометрических смесей с возможностью определения лимитирующего вещества реакции,
- производительность реакции.
Молярная масса
Из-за немыслимо малой массы отдельных атомов и молекул была создана единица (u) — единица, выражающая атомную массу. На практике это величина, равная 1/12 массы изотопа углерода 12C. Эта доля вещества тесно связана с постоянной Авогадра и определяется как количество граммов вещества, содержащего 6,022-1023 атомов, молекул или ионов. Молярная масса [M] численно равна атомной или молекулярной массе, а единицей измерения является г/моль.
Молярный объем вещества [Vm]
Это специфическая для каждого вещества величина, которая сильно зависит от температуры и давления. Это объем вещества, занимаемый одним его молем. В нормальных условиях принимается постоянное значение 22,4 дм3.
Закон постоянства состава и сохранения массы
Каждое химическое соединение, независимо от его происхождения и способа получения, имеет вполне определенный и постоянный как качественный, так и количественный состав. Например, оксид серы (IV) всегда содержит 50 весовых процентов серы, а оксид серы (VI) — 40 весовых процентов этого элемента. В закрытой системе масса образующихся продуктов равна массе субстратов, израсходованных в ходе реакции. Закон сохранения массы отражается в необходимости уравновешивать каждое уравнение химической реакции соответствующими химическими коэффициентами так, чтобы обе стороны уравнения были равны по количеству присутствующих атомов. Стехиометрические соотношения отражают молярные соотношения реактантов, участвующих в рассматриваемой химической реакции.
Уравнение химической реакции
Вся необходимая информация об относительно возникающих отношениях между химическими веществами содержится в уравнении химической реакции. Из него можно почерпнуть некоторые важные относительные и количественные данные.
Пример 1.
Из уравнения синтеза аммиака следует реакция:
![]()
мы можем провести несколько интерпретаций — молекулярную, молярную, в молярных массах, в молярных объемах и в количестве молекул.
a) На молекулярном уровне мы можем прочитать, что три молекулы водорода реагируют с одной молекулой азота, образуя две молекулы аммиака.
b) Это также означает, что три моль водорода реагируют с одним моль азота, образуя продукт в виде двух моль аммиака.
c) Используя периодическую таблицу химических элементов, в которой указаны молярные массы отдельных атомов, мы также можем сделать вывод из уравнения, что 6 г водорода полностью прореагировали с 28 г азота, образовав 34 г аммиака.
d) Тогда, при нормальных условиях, мы знаем, что один моль газа занимает 22,4 дм3. Это позволяет сделать вывод, что 67,2 дм3 водорода реагирует с 22,4 дм3 азота, образуя 44,8 дм3 аммиака.
e) Еще одно полезное соотношение — закон Авогадра, который гласит, что равные объемы различных газов содержат одинаковое количество частиц при одинаковых условиях давления и температуры. Зная постоянную Авогадра, равную 6,022-1023, мы знаем, что для осуществления полной химической реакции синтеза аммиака нам потребуется 3-6,022-1023 молекул водорода и 6,022-1023 молекул азота. В результате реакции образуется 2-6,022-1023 молекул аммиака.
Пример 2.
Реакция горения магния в хлоре протекает по уравнению:
![]()
позволяет прийти к интерпретации, аналогичной предыдущему примеру.
a) Даже на первый взгляд представленное уравнение позволяет сделать вывод, что для получения одной молекулы хлорида магния необходимо предоставить в качестве субстратов одну молекулу магния и одну молекулу хлора.
b) Это, конечно, эквивалентно количеству молей, присутствующих в системе, то есть один моль магния, один моль хлора, один моль хлорида магния.
c) Для расчетов массы мы знаем, что 24 г магния реагируют с 71 г хлора, образуя 95 г хлорида магния.
d) Поскольку в рассматриваемой химической реакции участвует только один газ — хлор, для него также можно записать, что он занимает объем 22,4 дм3.
e) При подсчете частиц каждый компонент равен другому и принимает значение 6,022-1023.
Процентный выход химической реакции [%W]
Стехиометрические расчеты также используются для определения выхода реакции, т.е. отношения фактического количества полученного продукта к количеству, полученному из уравнения химической реакции.
Пример 1.
В присутствии платинового катализатора была проведена реакция окисления 30 кг оксида серы(IV), в результате которой было получено 34 кг оксида серы(VI). С какой эффективностью проходил процесс?
Уравнение химической реакции:
![]()
Из записанной реакции видно, что два моля оксида серы(IV) дают столько же молей оксида серы(VI). Зная молярные массы реагирующих веществ, мы знаем, что стехиометрически, при условии 100%-ного выхода, 128 г SO2 дают 160 г SO3. Благодаря этому мы можем составить пропорцию:
0,128 кг SO2 — 0,160 кг SO3
30 кг SO2 — x кг SO3
Отсюда мы узнаем количество оксида серы(VI), которое будет произведено при 100-процентной эффективности.
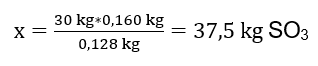
Зная теоретическое и фактическое количество SO3, мы можем рассчитать выход, при котором произошла интересующая нас реакция.
37,5 кг SO3 — 100% производительность
34 кг SO3 – x% эффективности
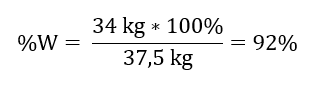
Окисление оксида серы(IV) до оксида серы(VI) с использованием платинового катализатора происходит с эффективностью 92%.
Вещественные и элементарные формулы
Еще одно применение стехиометрических расчетов — определение формул простых химических соединений. Действительная формула — это суммарная формула химического соединения, которая совпадает с эмпирической формулой или является ее целым кратным числом. Если известно, что общая формула химического соединения — NxOy, то значения стехиометрических индексов можно рассчитать, разделив массу атомов на их атомные массы. Если молекулярная масса химического соединения неизвестна, а известен только его процентный состав, можно привести только элементную формулу. Он может быть истинным представлением формулы суммы или просто определять соотношение отдельных элементов.
Пример 1.
Молекулярная масса химического соединения составляет 92 u, оно состоит из 30,43% азота и 69,57% кислорода. Какова реальная формула рассматриваемого химического соединения?
Поскольку сумма молекул, присутствующих в соединении, равна 100%, можно предположить, что:
92 u — 100%
Это позволяет рассчитать содержание отдельных элементов:
92 u — 100%
x u азота — 30,43%
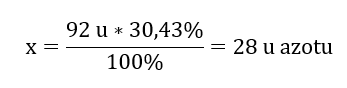
Отсюда следует, что масса одного атома кислорода равна:
92 u — 28 u = 64 u
Зная индивидуальные массы элементов, мы можем определить стехиометрические индексы:
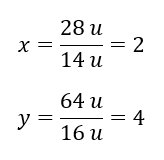
Фактическая формула этого химического соединения — N2O4.
Пример 2.
В химическом соединении есть два элемента — кислород в количестве 60 % и сера в количестве 40 %. Какова его элементарная формула?
Общая формула — SxOy, где x составляет 40%, а y — 60%. Зная молярные массы отдельных элементов, это можно представить следующим образом:
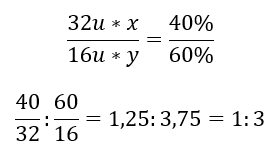
Это означает, что в данном химическом соединении на один атом серы приходится три атома кислорода. Элементарная формула — SO3.

Избыточный и ограничивающий субстрат
В случае реакций, в которых реактанты присутствуют в соотношениях, отличающихся от соответствующих стехиометрии, один из реактантов полностью перереагирует, и реакция прекратится. В этом случае он присутствует в виде предельного реактива, в то время как второй реактив будет находиться в системе в избытке и по завершении реакции все еще будет присутствовать в системе в своей первичной форме.
Пример 1.
В лаборатории 40 см3 0,25 М раствора сульфата алюминия прореагировали с 50 см3 0,5 М раствора хлорида бария. Сколько граммов осадка образуется?
Уравнение химической реакции:
![]()
Первый шаг к тому, чтобы узнать реальный ход реакции, — это определение реального количества молей веществ, участвующих в реакции.
nAl2(SO4)2: C Al2 (SO4) 2 — V Al2(SO4)2 = 0,25 — 0,04 дм3 = 0,010 моль
nBaCl2: C BaCl2 — V BaCl2 = 0,5 — 0,05 дм3= 0,025 моль
Второй шаг заключается в определении количества субстрата, присутствующего в нижнем потоке, на основе стехиометрии реакции — это определит количество образовавшегося осадка.
1 моль Al2(SO4)3 — 3 моль BaCl2
0,010 моль Al2(SO4)3 – x моль BaCl2
Для полного проведения реакции, имея 0,010моль Al2(SO4)3, необходимо добавить в систему 0,030моль BaCl2. Однако хлорид бария вступает в реакцию только с 0,025 моль, что означает его дефицит и ограничение реакции. Поэтому количество образовавшегося в ходе реакции осадка следует рассчитывать по количеству этого субстрата.
Количество молей хлорида бария, используемое в соответствии со стехиометрией реакции, равно количеству молей образовавшегося осадка, таким образом:
nBaSO4 = nBaCl2
0,025 моль BaSO4 = 0,025 моль BaCl2
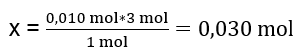
Зная количество молей сульфата бария, мы можем рассчитать его массу:
mBaSO4 = nBaSO4 —MBaSO4
mBaSO4 = 0,025моль — 233,393 г/моль = 5,835г
В результате реакций и количеств субстратов, указанных в задании, образуется 5,835 г осадка сульфата бария.