Z hľadiska chemickej štruktúry patria alkány do skupiny uhľovodíkov. Tieto zlúčeniny obsahujú iba dva typy atómov: uhlík a vodík. Skladajú sa zo základnej uhlíkovej štruktúry spojenej s atómami vodíka. Alkány majú iba jednoduché väzby, preto sa nazývajú nasýtené uhľovodíky.

Homológna séria
Zástupcovia alkánov, usporiadaní podľa rastúceho množstva atómov vodíka v ich štruktúre, tvoria homológny rad. Začína sa metánom, ktorý obsahuje jeden atóm uhlíka, a končí dekánom s deviatimi atómami uhlíka. Názvy alkánov vychádzajú z množstva atómov uhlíka, ktoré existujú v štruktúre a sú definované gréckymi alebo latinskými číslicami, ako aj charakteristickou koncovkou -ane, ako pri heptáne, nonáne atď. Všeobecný vzorec pre alkány je nasledujúci: , kde ‘n’ predstavuje uhlíkové (C) číslo prítomné v reťazci a ‘H’ predstavuje atómy vodíka.
| Počet atómov uhlíka prítomných v reťazci | Alkánový vzorec | Alkánový názov |
| 1 | CH 4 | metán |
| 2 | C2H6 _ | Etan |
| 3 | C3H8 _ | Propán |
| 4 | C4H10 _ | bután |
| 5 | C5H12 _ | pentán |
| 6 | C6H14 _ | Hexán |
| 7 | C7H16 _ | heptán |
| 8 | C8H18 _ | Oktánový |
| 9 | C9H20 _ | Nonane |
| 10 | C10H22 _ | Decane |
Druhy nasýtených uhľovodíkov
Z hľadiska štruktúry reťazca rozlišujeme tieto typy alkánov:
-
Lineárne (parafínové) alkány
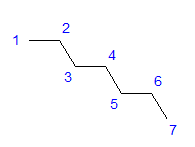 Obr. 1 Štruktúrny vzorec heptánu Všetky atómy uhlíka vykazujú sp3 hybridizáciu. Vzhľadom na štvoruholníkový uhol medzi väzbami je potrebné cikcakovité usporiadanie atómov uhlíka. Molekuly môžu mať rôzne usporiadania, pretože okolo jednoduchej väzby medzi atómami uhlíka je možná voľná rotácia. Čím vyššie je uhlíkové číslo v štruktúre, tým rozmanitejšie môžu byť tvary reťazcov.
Obr. 1 Štruktúrny vzorec heptánu Všetky atómy uhlíka vykazujú sp3 hybridizáciu. Vzhľadom na štvoruholníkový uhol medzi väzbami je potrebné cikcakovité usporiadanie atómov uhlíka. Molekuly môžu mať rôzne usporiadania, pretože okolo jednoduchej väzby medzi atómami uhlíka je možná voľná rotácia. Čím vyššie je uhlíkové číslo v štruktúre, tým rozmanitejšie môžu byť tvary reťazcov.
-
Izoalkány: rozvetvené nasýtené uhľovodíky
Tvorba rozvetvených uhľovodíkov je výsledkom spojenia medzi atómom uhlíka a viac ako dvoma ďalšími atómami uhlíka. V mieste takéhoto spojenia sa vytvorí vetva. Rozvetvené uhľovodíky sú lineárne izoméry uhľovodíkov. 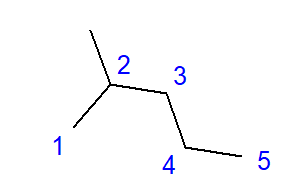 Obr. 2 Štruktúrny vzorec pre 2-metylpentán Vzorec pre 2-metylpentán uvedený na Obr. 2 má celkom šesť atómov uhlíka a je izomérom hexánu. Názov „2-metylpentán“ znamená, že reťazec pentánu má v polohe druhého atómu uhlíka pripojenú metylovú skupinu. Počet možných štruktúrnych izomérov rastie spolu s rastúcim počtom uhlíkov. Aby sme uviedli príklad, hexán môže mať štruktúru 5 rôznych izomérov, oktán má 18 takýchto možností a hexán až 75.
Obr. 2 Štruktúrny vzorec pre 2-metylpentán Vzorec pre 2-metylpentán uvedený na Obr. 2 má celkom šesť atómov uhlíka a je izomérom hexánu. Názov „2-metylpentán“ znamená, že reťazec pentánu má v polohe druhého atómu uhlíka pripojenú metylovú skupinu. Počet možných štruktúrnych izomérov rastie spolu s rastúcim počtom uhlíkov. Aby sme uviedli príklad, hexán môže mať štruktúru 5 rôznych izomérov, oktán má 18 takýchto možností a hexán až 75.
-
Cyklické uhľovodíky: cykloalkány, alicyklické uhľovodíky
Je možné uzavrieť štruktúru reťazca pri vytváraní kruhov zložených z opakujúcich sa prvkov –CH 2 -. Názvy sú založené na názve alkánu s predponou „cyklo-“, ako napríklad cyklobután alebo cykloheptán. Aby to bolo jednoduchšie, môžu byť prezentované ako pravidelné polygóny. 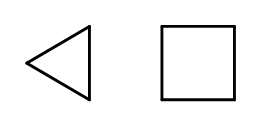 Obr. 3 Zľava: cyklopropán, cyklobután Existujú aj substitučné kruhy, ktorých názvy zahŕňajú substituenty. V tomto prípade sú počty atómov uhlíka navrhnuté tak, že umiestnenie substituentov je možno nízke.
Obr. 3 Zľava: cyklopropán, cyklobután Existujú aj substitučné kruhy, ktorých názvy zahŕňajú substituenty. V tomto prípade sú počty atómov uhlíka navrhnuté tak, že umiestnenie substituentov je možno nízke.
Najdôležitejší predstavitelia
Metán je zlúčenina s molekulovým vzorcom CH4 , ktorá začína homologickú sériu alkánov. Uhlík je štvormocný, takže má štyri väzby CH. Pri izbovej teplote je to plyn bez farby a zápachu. Keďže atóm uhlíka vykazuje hybridizáciu sp3 , je štruktúrovaný ako štvorsten a vytvorené orbitály tvoria ekvivalentné väzby spolu so štyrmi atómami vodíka. Etán je ďalší alkán v rade, ktorého molekulový vzorec je C2H6 . Pri pohľade na pološtrukturálny vzorec H3C – CH3 si všimneme, že každý atóm uhlíka je spojený s tromi atómami vodíka. Rovnako ako metán a iné nižšie uhľovodíky je to bezfarebný plyn bez zápachu. CH väzby sú frontálne sigma sp-s väzby, zatiaľ čo jednoduchá väzba medzi uhlíkovými atómami je frontálna sigma sp-sp väzba.
Syntéza alkánov
- Hydrogenácia alkénov alebo alkínov

- Hydrolýza Grignardových zlúčenín
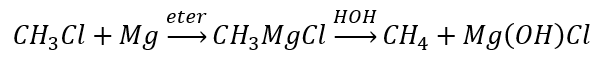
- Redukcia alkylhalogenidov
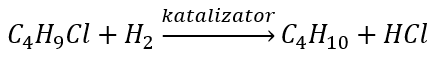
- Wurtzova reakcia
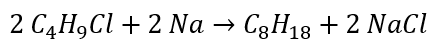
Redukcia aldehydov a ketónov
- Clemmensenova redukcia
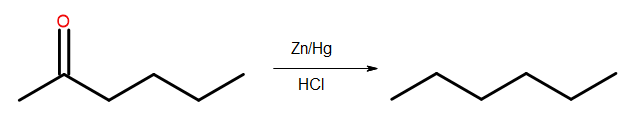 Obr. 4 Schéma Clemmensenovej redukcie
Obr. 4 Schéma Clemmensenovej redukcie
- Wolff-Kishnerova reakcia
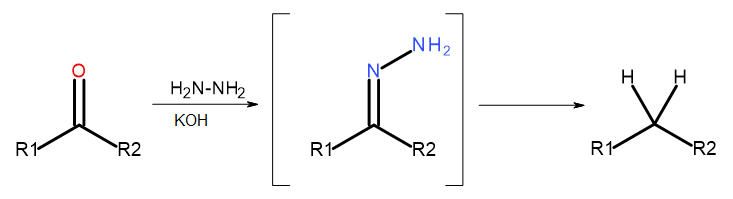 Obr. 5 Schéma Wolff-Kishnera
Obr. 5 Schéma Wolff-Kishnera
Fyzikálno-chemické vlastnosti alkánov
Alkány s krátkym reťazcom od C 1 do C 4 pri izbovej teplote sú plyny. Ďalšie homológy (začínajúc od pentánu) sú kvapaliny s rastúcou teplotou varu. Vetvy prítomné v štruktúre majú za následok nižšiu teplotu varu izomérov. Závislosť pridania ďalšej –CH 2 – skupiny do štruktúry zvyšuje teplotu varu o 20–30 o C vyššie spolu so zväčšovaním dĺžky uhlíkového reťazca. Stav agregácie alkánov od oktadekánu vyššie je pevný s teplotami topenia od 28 ° C pre n-oktadekán. Pevné uhľovodíky zahŕňajú parafín, zatiaľ čo vyššie kvapalné uhľovodíky zahŕňajú parafínový olej. Vďaka svojej hydrofóbnej povahe sa molekuly alkánov nemiešajú s vodou, nie sú zmáčané vodou a nerozpúšťajú sa vo vode. Vďaka svojej afinite k nepolárnym charakteristikám sa však ľahko rozpúšťajú samy osebe a v podobných nepolárnych, stredne a nízkopolárnych organických rozpúšťadlách. Rozpustnosť alkánov v dvoch populárnych alkoholových rozpúšťadlách (metanol a etanol) je relatívne dobrá. V metanole sa alkány dobre rozpúšťajú len do stanovenej koncentrácie. Nadbytok tejto koncentrácie spôsobí oddelenie fáz. V etanole sa nižšie alkány veľmi ľahko rozpúšťajú, zatiaľ čo vyššie alkány sa rozpúšťajú o niečo ťažšie. Vyššie uhľovodíky sú horľavé látky. Plynné uhľovodíky ako aj páry kvapalných uhľovodíkov tvoria po zmiešaní so vzduchom zmesi s potenciálom výbuchu. Reaktivita alkánov je relatívne nízka v dôsledku nedostatku potenciálne reaktívnych funkčných skupín. Väzby medzi atómami uhlíka (CC), ako aj medzi atómami uhlíka a kyslíka (CH) sú vysoko odolné voči štiepeniu. Energie týchto väzieb sú 88 kcal/mol a 104 kcal/mol. Môžu náhle reagovať len za určitých podmienok.
Reakcie alkánov
- Úplné spaľovanie – s emisiami oxidu uhličitého
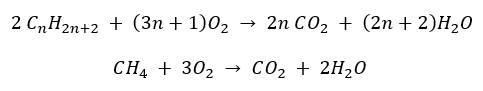
- Polospaľovanie – s obmedzeným množstvom kyslíka a emisií oxidu uhoľnatého
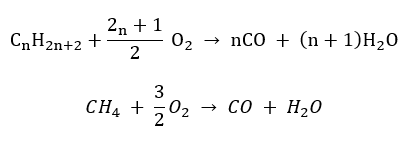
- Nedokonalé spaľovanie – sadze vznikajú s veľmi obmedzeným množstvom kyslíka
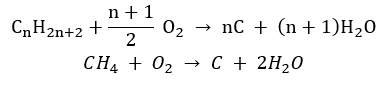
- Substitučná reakcia (radikálová halogenácia, príkladom je reakcia metánu s chlórom za účasti svetla)
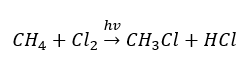
- Pyrolýza je rozklad alkánov na menšie molekuly pri veľmi vysokej teplote. V závislosti od procesu môže dôjsť k praskaniu, hydrokrakovaniu alebo izomerizácii.
- Nitrácia s použitím kyseliny dusičnej (V) a tvorba zmesi produktov: izoméry so substituentom –NO 2 na rôznych miestach.
- Dvojstupňová sulfonácia, kde mersoly sú medziprodukty a mersolány sú konečným produktom.
























































































































