Alkény sú nenasýtené uhľovodíky, ktoré podobne ako alkány tvoria homológny rad. Na rozdiel od alkánov však majú alkény jednu viacnásobnú väzbu – dvojitú väzbu – medzi atómami uhlíka. Zostávajúce sú jednoduché väzby, ale výskyt čo i len jednej násobnej väzby v molekule robí z uhľovodíka nenasýtenú zlúčeninu.

Štruktúra alkénov
CC väzba medzi atómami v nasýtených uhľovodíkoch spôsobuje, že každý z nich má hybridizáciu sp3 . V alkénoch, ktoré majú väzby C=C, dochádza k hybridizácii sp2 . Táto vlastnosť spôsobuje, že štruktúra zlúčenín s dvojitými väzbami je trigonálna. Jeho 3 sigma väzby sú v rovnakej rovine a smerujú k rohom rovnostranného trojuholníka, ktorého stredom je atóm uhlíka. Naopak, väzby pí sú výsledkom prekrývania nehybridného orbitálu p v smere kolmom na trojuholník, ktorý je vytvorený z hybridných orbitálov a orbitálov podobnej symetrie susedného atómu. Najjednoduchšou konštrukciou skupiny a prvou zlúčeninou v sérii homologických alkénov je etén. Metán, zlúčenina, ktorá je prvým z alkánov, nemohla vytvoriť násobnú väzbu.
Príklad štruktúry alkénu
Vezmime si najjednoduchšiu zlúčeninu skupiny, etén, a preskúmame jej štruktúru. Vieme, že atómy uhlíka v molekule eténu majú hybridizáciu sp2 , takže molekula je plochá. Uhly medzi väzbami v tomto rozložení sú 120 o . Štyri väzby medzi atómami uhlíka a vodíka prítomnými v štruktúre CH sú sigma δ SP-s väzby s čelným prekrytím. Medzi atómami uhlíka sú tiež vytvorené homonukleárne väzby. Jedným je CC δ sp-sp a druhým je CC π pp , ktorý je vytvorený z nehybridných p orbitálov.
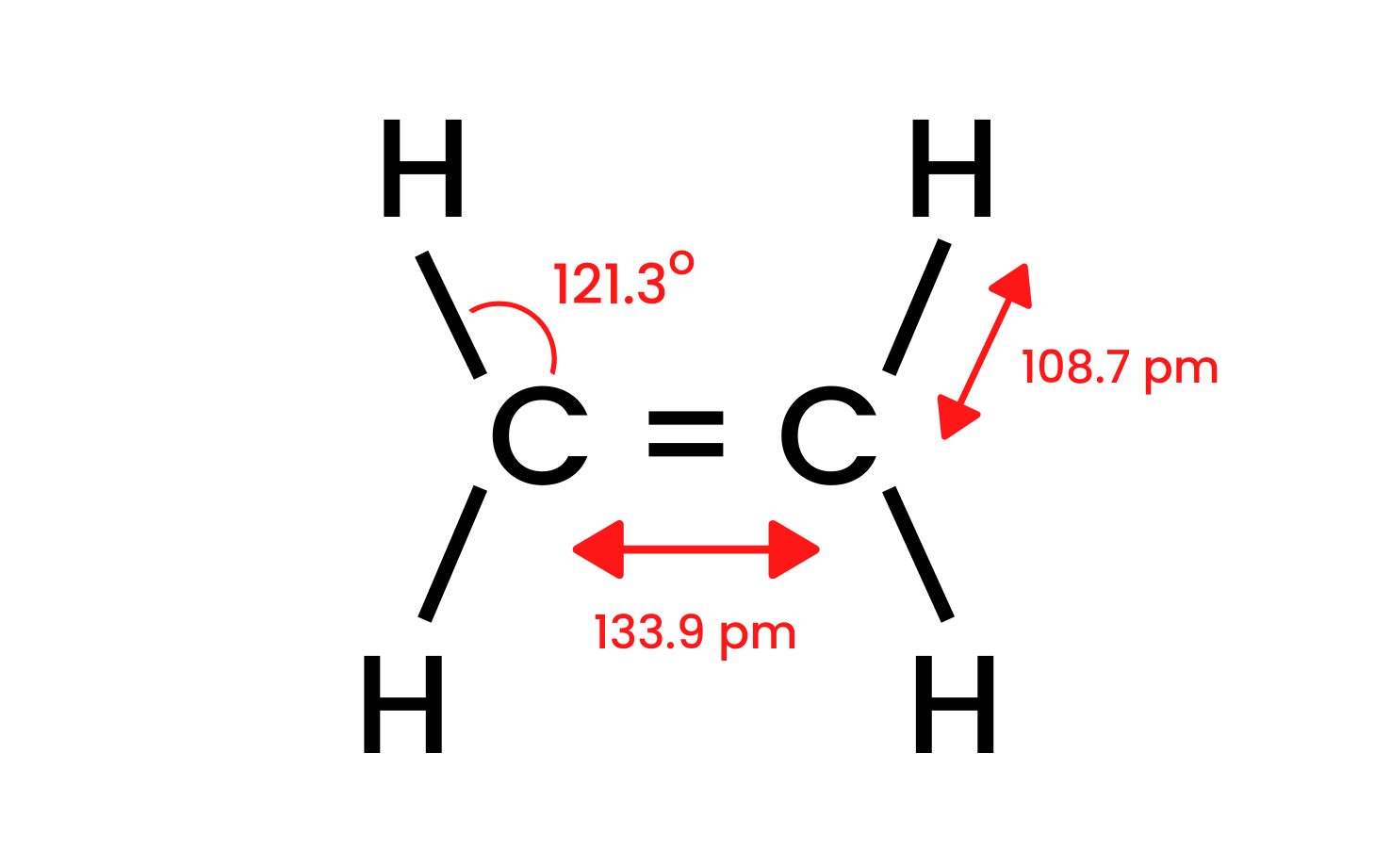
Obrázok 1. Štruktúra eténu
Alkénová homologická séria
Homológna séria je skupina chemických zlúčenín, ktoré majú veľmi podobnú chemickú štruktúru a vlastnosti. Takéto látky môžu byť tiež napísané spoločným molekulárnym vzorcom. Všeobecný vzorec pre alkény možno zapísať ako CnH2n . Štrukturálne to vyzerá takto:
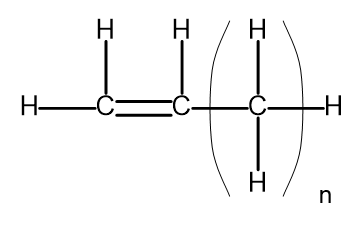
Obrázok 2. Všeobecný štruktúrny vzorec pre alkény
| Počet atómov uhlíka v reťazci | Alkánový vzorec | Alkánový názov | Alkénový vzorec | Názov alkénu |
| 2 | C2H6 _ | Etan | C2H4 _ | Ethene |
| 3 | C3H8 _ | Propán | C3H6 _ | Propene |
| 4 | C4H10 _ | bután | C4H8 _ | butén |
| 5 | C5H12 _ | pentán | C5H10 _ | pentén |
| 6 | C6H14 _ | Hexán | C6H12 _ | Hexene |
| 7 | C7H16 _ | heptán | C7H14 _ | heptén |
| 8 | C8H18 _ | Oktánový | C8H16 _ | Octene |
| 9 | C9H20 _ | Nonane | C9H18 _ | None |
| 10 | C10H22 _ | Decane | C10H20 _ | Decene |
Zlúčeniny od buténu po decén môžu mať vetvy na rovnakých miestach atómov uhlíka, takže sa môžu nazývať aj but-1-én, hept-1-én alebo dec-1-én. To znamená, že nenasýtená väzba je prítomná medzi atómami uhlíka, ktoré začínajú reťazec. Fenomén rôznych možností umiestnenia nenasýtenej násobnej väzby sa nazýva pozičná izoméria. Napríklad zlúčenina s molekulovým vzorcom C7H14 má niekoľko možných polohových izomérov. Dvojitá väzba v jej štruktúre môže byť umiestnená napríklad na atómoch uhlíka číslo jedna a tri, ako je znázornené na obrázku 3.
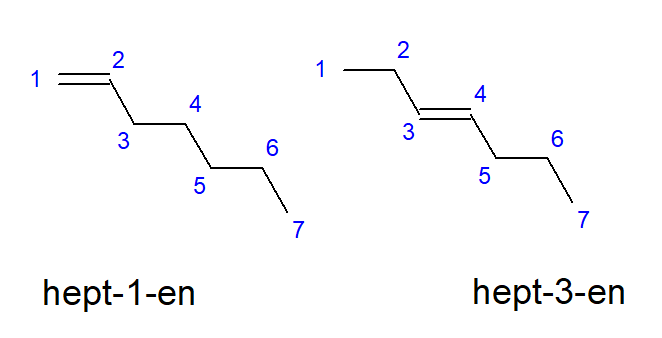
Obrázok 3. Štrukturálne vzorce hept-1-énu (1-hepténu) a hept-3-énu (3-hepténu)
Štruktúra alkénov – zhrnutie
Každý alkén má dvojitú pí väzbu (π), na ktorej sa vytvárajú ploché štruktúry. Atómy uhlíka majú hybridizáciu sp2 , ktorá sa vyznačuje trigonálnou formou. V nasýtených lokalitách môžu –CH 2 – metylénové skupiny vytvárať priestorovo rozšírené priame a rozvetvené reťazce. K rotácii dochádza iba okolo jednoduchých väzieb a nevyskytuje sa v prípade väzby C=C. Základné fyzikálne a chemické vlastnosti skupiny alkénov Alkény majú hydrofóbne vlastnosti, a preto majú nepolárnu povahu. Vstupujú do reakcií s vodou. Vďaka svojej afinite sa dobre rozpúšťajú v nepolárnych rozpúšťadlách, ako sú alkány. Teplota topenia, teplota varu a hustota alkénov sa zvyšujú so zvyšujúcim sa počtom atómov uhlíka v molekule. Ich aktivita je najväčšia u alkénov s krátkym reťazcom.
Získavanie alkénov
Existuje niekoľko spôsobov, ako získať alkény. Každý z týchto spôsobov je založený na eliminácii dvoch substituentov na jednej väzbe, ako je znázornené na diagrame:
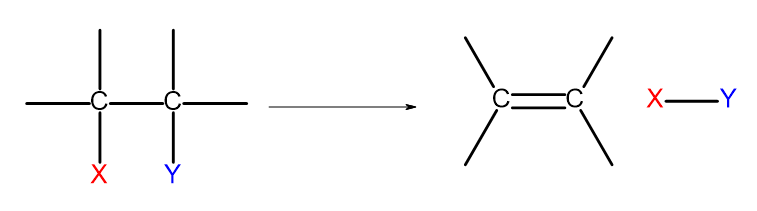
Obrázok 4. Diagram eliminačného procesu, ktorý vedie k tvorbe alkénu
Získavanie eténu
1. Dehydrogenácia alkánu 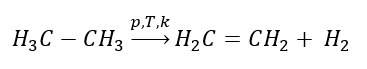 2. Dehydratácia alkoholu
2. Dehydratácia alkoholu 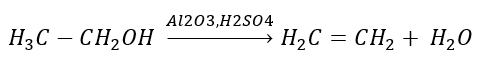 3. Reakcia halogénalkánu so silnou zásadou
3. Reakcia halogénalkánu so silnou zásadou 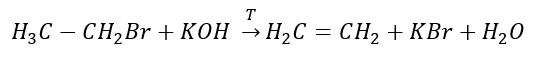 4. Reakcia dihalogén-alkánu so zinkovým prachom
4. Reakcia dihalogén-alkánu so zinkovým prachom 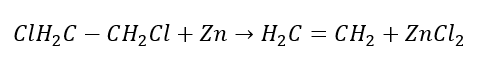 5. Hydrogenácia alkínu
5. Hydrogenácia alkínu 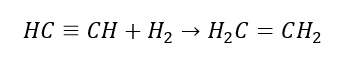
Chemické reakcie alkénov
Časticovo špecifický fragment, ktorý zároveň definuje jeho vlastnosti a príslušnosť, sa nazýva funkčná skupina. Pre alkény je touto skupinou dvojitá väzba (C=C). Pi väzba (π), ktorú obsahuje, je veľmi náchylná na zlomenie. V porovnaní s elektrónmi sigma väzieb sú elektróny, ktoré zaberajú orbitál pí, ďalej od atómov uhlíka, a preto sú s nimi menej spojené. To má za následok ich väčšiu mobilitu a väčšiu dostupnosť pre blížiace sa činidlá, čo vedie k vysokej chemickej reaktivite väzby. Existuje niekoľko typov reakcií, podľa ktorých sa alkény transformujú. Sú to: elektrofilná adícia, adícia voľných radikálov, oxidácia a redukcia, polymerizácia a alylová substitúcia.
Elektrofilný prídavok
Kvôli povahe elektrónov pí väzby majú činidlá, ktoré na ne útočia, elektropozitívny charakter. Takéto molekuly sú elektrofilné činidlá, ktoré majú vysokú afinitu k elektrónom. Vo väčšine prípadov je týmto faktorom protón kyslého pôvodu, elektrónová medzera alebo molekula, ktorá sa ľahko polarizuje v dôsledku blízkosti pí elektrónov. Adícia, tj spojovacia reakcia, sleduje iónový mechanizmus. Ide o dvojstupňový mechanizmus, pri ktorom pôvodne blížiace sa elektrofilné činidlo zachytáva elektróny pí väzby s vytvorením jednoduchej väzby a vytvorením prechodného karbokationu. Táto vysoko reaktívna molekula rýchlo útočí na iné činidlá, ktoré majú schopnosť vzájomne spájať elektróny. Príkladmi takýchto reakcií sú adície chlóru alebo brómu k alkénu. Vodík môže byť tiež pridaný (hydrogenizácia) adíciou, ale nie je elektrofilný.
Adičné reakcie s voľnými radikálmi
Mnohé reakcie alkénov poukazujú na nesúlad s Markovnikovovým pravidlom. Ich mechanizmus sa sústreďuje na reakciu elektrónov pí väzby na voľné radikály, počas ktorej vzniká väzba častíc napádajúcich uhlík. V dôsledku týchto zmien sa získa nový voľný radikál, ktorý má na susednom atóme uhlíka nepárový elektrón.
Alylická substitúcia
Okrem reakcie zahŕňajúcej dvojitú väzbu môžu alkény tiež reagovať spôsobom, ktorý je podobný ako u alkánov v susedných alkylových skupinách. Príkladom takejto reakcie je substitúcia atómu vodíka halogénom na atóme vedľa atómu uhlíka, ktorý tvorí dvojitú väzbu. Táto reakcia neovplyvňuje nenasýtenú časť štruktúry.
