Chemická aktivita je podľa definície schopnosť prvku darovať elektróny v chemických reakciách. V praxi sa ich aktivita zvyšuje s klesajúcou elektronegativitou – mierou schopnosti prvku priťahovať elektróny. Ak kov silne nepriťahuje elektróny, je reaktívnejší. Referenčný prvok, vodík, sa používa na klasifikáciu chemickej aktivity kovov. Meradlom aktivity kovu je jeho schopnosť vytesniť vodík z kyselín alebo vodík z molekuly vody.

Rad chemickej aktivity kovov
Tento výraz sa používa na opis súhrnu chemických prvkov, ktoré sú svojou povahou kovové , v špecifickom poradí od najmenej po chemicky najviac aktívne. Používa sa na porovnanie aktivity rôznych kovov. Okrem kovov rad chemickej aktivity zahŕňa aj jeden nekov, vodík , ktorý je referenčným prvkom. Čím vyššie v rade aktivít je kov, tým je reaktívnejší . Súvisí to aj s tým, že sa ľahšie oxiduje, a preto je silnejším redukčným činidlom a chemicky aktívnejším prvkom. Na rozdiel od toho, čím nižšie v rade aktivít je kov umiestnený, tým je menej reaktívny. To znamená, že ľahšie podlieha redukčnej reakcii a je teda silnejším oxidantom, menej aktívnym prvkom. Pomocou hodnôt uvedených v tabuľke 1 môžeme vidieť, že čím nižšia je hodnota štandardného potenciálu prvku, tým silnejšie je redukčné činidlo a tým je kov chemicky reaktívnejší. Meradlom schopnosti darovať elektróny pri rôznych činnostiach s kovmi je ich štandardná potenciálna hodnota . Pre vodík, alebo skôr vodíkovú elektródu, sa predpokladá, že štandardný potenciál je nulový. Štandardný potenciál je elektromotorická sila článku zloženého zo štandardného vodíkového polčlánku a druhého polčlánku, v ktorom sú koncentrácie substrátov a produktov 1 mol/dm 3 .
| elektróda | Štandardný potenciál [V] |
| Li/Li + | -3.04 |
| Ca/Ca 2+ | -2,86 |
| Mg/Mg 3+ | -2,36 |
| Al/Al 3+ | -1,69 |
| Mn/Mn 2+ | -1,18 |
| Zn/Zn 2+ | -0,76 |
| Cr/Cr 3+ | -0,74 |
| Fe/Fe 2+ | -0,44 |
| Cd/Cd 2+ | -0,40 |
| Co/Co 2+ | -0,28 |
| Ni/Ni 2+ | -0,26 |
| Sn/Sn 2+ | -0,14 |
| Pb/Pb 2+ | -0,14 |
| Fe/Fe 3+ | 0,04 |
| H2 /2H + | 0,00 |
| Bi/Bi 3+ | +0,32 |
| Cu/Cu 2+ | +0,34 |
| Ag/Ag + | +0,80 |
| Hg/Hg 2+ | +0,85 |
| Au/Au 3+ | +1,52 |
Stôl 1 . Elektrochemický rad kovov Kovy viditeľné v hornej časti radu sú najaktívnejšie. Tie nad vodíkom majú tendenciu ľahko oxidovať, a preto sú silnejšími redukčnými činidlami ako vodík. Prvky pod vodíkom v sérii sa ľahšie redukujú a sú silnejšími oxidačnými činidlami. Ak má kov negatívnejší potenciál ako iný, znamená to, že ho vytlačí zo svojej soli. Napríklad železo nahradí meď v soliach medi, ale meď nevytlačí železo zo svojich solí. Namiesto toho môže vytesniť striebro zo strieborných solí. Lítium a berýlium z roztokov solí iných kovov ich nevytláčajú, ale priamo reagujú s vodou. Vytláčajú vodík a produkujú svoje zlúčeniny – hydroxidy . Takéto kovy sa nazývajú aktívne kovy. Aktivita kovov a periodická tabuľka prvkov Podobne ako mnohé iné vlastnosti, aj chemická aktivita prvku môže byť odvodená z jeho polohy v periodickej tabuľke prvkov . Najaktívnejšie kovy sú v skupine I a II, pretože ľahko vytláčajú vodík z vody za vzniku hydroxidov. V skupine sa chemická aktivita kovov zvyšuje so zvyšujúcim sa atómovým číslom . Perióda sa znižuje so zvyšujúcim sa atómovým číslom. 
Drahé a základné kovy
Vodík poskytuje nielen referenčný bod aktivity, ale tiež oddeľuje vzácne a základné kovy v sérii . Základné kovy sú tie, ktoré sú vyššie ako vodík. Každý z nich reaguje s kyselinami a vytláča z nich vodík. Od draslíka po vápnik reagujú s vodou už pri izbovej teplote a od horčíka po železo s ňou reagujú pri zvýšených teplotách. Všetky kovy, ktoré sú v sérii aktivít pod vodíkom , nevytláčajú vodík z kyselín . Môžu však reagovať s oxidačnými kyselinami za vzniku zodpovedajúcich solí a oxidov , ktoré vznikajú redukciou zvyšku kyseliny. Prvky v spodnej časti série, od striebra po zlato, sú tak vysoko odolné voči chemickým reakciám, že reagujú iba s vodnou révou . Takýto roztok je zmesou koncentrovaného roztoku kyseliny chlorovodíkovej a koncentrovaného roztoku kyseliny dusičnej (V) , zmiešané v objemovom pomere 3:1. Keď poznáme tieto skutočnosti, môžeme odvodiť, že na rozlíšenie aktivity prvku je možné vykonať niekoľko reakcií: s vodou pri izbovej teplote, s horúcou vodou, s neoxidačnou kyselinou, s oxidujúcou kyselinou a s vodnou révou.
Experiment na detekciu kovov vytláčajúcich vodík z kyselín
Najjednoduchší spôsob, ako potvrdiť aktivitu kovu, je vykonať experiment. Na tento účel by sa malo pripraviť desať skúmaviek, do ktorých sa postupne umiestni: v 1-5: horčíková stuha, zinkový drôt, železný drôt, niklový drôt a medený drôt. Rovnaké poradie by sa malo opakovať v skúmavkách 6-10. Pridajte niekoľko mililitrov kyseliny chlorovodíkovej do skúmaviek 1-5 a niekoľko mililitrov zriedenej kyseliny sírovej (VI) do skúmaviek 6-10. Na každú trubicu priložte horiacu dlahu. V skúmavkách, ktoré obsahujú horčíkové pásky a železné, zinkové a niklové drôty, zaplavené kyselinami, sa uvoľňujú bubliny plynu. Najintenzívnejšie uvoľňovanie možno pozorovať v skúmavkách s obsahom horčíka. Reakcie, ktoré prebiehajú, sú nasledovné: 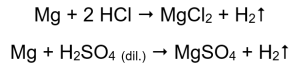 Množstvo emitovaného plynu klesá v sérii: zinok, železo, nikel. Podľa toho prebiehajú nasledujúce reakcie:
Množstvo emitovaného plynu klesá v sérii: zinok, železo, nikel. Podľa toho prebiehajú nasledujúce reakcie:  V rúrkach, ktoré obsahovali medené drôty, nie je viditeľný žiadny plyn, žiadna zmena. To znamená, že takéto reakcie sa nevyskytujú:
V rúrkach, ktoré obsahovali medené drôty, nie je viditeľný žiadny plyn, žiadna zmena. To znamená, že takéto reakcie sa nevyskytujú: 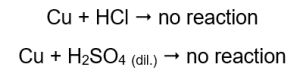 Pri priložení horiacej dlahy sa v trubiciach, z ktorých vychádza plyn, ozve výrazný zvuk.
Pri priložení horiacej dlahy sa v trubiciach, z ktorých vychádza plyn, ozve výrazný zvuk.
Zhrnutie pozorovaní a záverov:
Horčík, zinok, železo a nikel reagujú s kyselinou chlorovodíkovou aj s kyselinou sírovou (VI). Každý z nich vytesňuje vodík z kyseliny, čo znamená, že sú vyššie v rade aktivity kovu ako kyselina. Reakcie produkujú produkty vo forme solí a plynu, vodíka, ktorý sa uvoľňuje. Výrazný zvuk, ktorý sprevádzal priloženie svietiacej dlahy na skúmavku unikajúceho plynu, je spôsobený reakciou vodíka s kyslíkom. Zo všetkých testovaných kovov je najreaktívnejší horčík, za ním nasleduje zinok, železo, nikel a meď. Môžeme to povedať, pretože intenzita plynových bublín naznačuje aktivitu kovu. V skúmavkách, ktoré obsahovali meď, neboli pozorované žiadne zmeny. To ukazuje, že meď nie je schopná vytesniť vodík ani z kyseliny chlorovodíkovej, ani zo zriedenej kyseliny sírovej (VI).
