V prípade chemických reakcií sa úplná premena substrátov na produkty pozoruje len u malej časti z nich. Prevažná väčšina, vrátane tých, ktoré sa vyskytujú v našom tele, je reverzibilná. Pre takéto procesy sa ustanoví stav chemickej rovnováhy. Ide o mimoriadne dôležitý pojem v chémii, ktorý je spojený napríklad s Le Chatelierovým princípom (alebo so zákonom rovnováhy). Znalosť základných zákonov a princípov týkajúcich sa chemickej rovnováhy umožňuje napríklad predpovedať mnohé reakcie alebo efektívnejšie viesť technologické procesy.
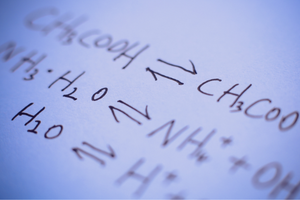
Reverzibilné a nezvratné reakcie
Berúc do úvahy priebeh chemických reakcií, je možné urobiť všeobecné rozdelenie – na vratné a nevratné reakcie. Treba však pripomenúť, že v skutočnosti neexistujú 100%nezvratné reakcie a kvalifikácia do konkrétnej skupiny je založená na prevažujúcom konečnom efekte.
Nezvratné reakcie
V tomto prípade substráty v systéme reagujú a výsledkom sú špecifické produkty. Nedochádza však k spätnej transformácii – produktov na substráty . Vo vzorci je medzi reaktantmi označená jedna šípka a šípka ukazuje smerom k produktom. Ireverzibilné reakcie sú predovšetkým tie, pri ktorých sa tvoria zrazeniny. V praxi sú nerozpustné vo vode a nemožno ich rekonštituovať. Reverzibilita procesu je tiež ťažko dosiahnuteľná v prípade reakcií prebiehajúcich v otvorených systémoch, teda v kadičke alebo guľovej banke, z ktorých môže jeden z výsledných produktov, napr. oxid uhličitý, voľne unikať, ale zmenou podmienok reakcie, tj prenesením do uzavretého systému, môže byť reverzibilná. Do skupiny ireverzibilných reakcií patria aj všetky procesy, pri ktorých dochádza k interakcii medzi molekulami produktu v oveľa menšej miere ako medzi substrátmi. Takýto proces teda prebieha oboma smermi, no vzhľadom na to, že rekonštitúcia substrátov je zanedbateľná, v praxi sa zaraďujú medzi nevratné reakcie.
Reverzibilné reakcie
Ide o reakcie, pri ktorých zo substrátov vznikajú produkty a zároveň s porovnateľnou intenzitou prebieha opačný proces – teda rekonštitúcia substrátov z produktov. V reakčnom vzorci sú medzi reaktanty umiestnené dve šípky, pričom šípky ukazujú v opačných smeroch, čo naznačuje reverzibilitu prebiehajúcich reakcií. Reverzibilné reakcie sú hlavne tie, ktoré sa uskutočňujú v uzavretých systémoch. Molekuly substrátov a produktov nie sú schopné opustiť reakčné prostredie a navzájom sa zrážajú, vytvárajú produkty a rekonštituujú substráty. Príkladom takejto reakcie je výroba jodovodíka z jódu a vodíka.
Stav chemickej rovnováhy
Či môže dôjsť k určitej reakcii, alebo či je reverzibilná alebo ireverzibilná, závisí vo veľkej miere od konkrétnych podmienok procesu a typu procesu. Ak prebieha reverzibilná reakcia, teda substráty sa v dôsledku chemickej reakcie menia na produkty a súčasne v dôsledku zrážok molekúl produktu dochádza k obnove substrátov, potom v určitom okamihu, keď tieto reakcie nastanú, je nastolený stav chemickej rovnováhy . Inými slovami, koncentrácie substrátov a produktov v systéme sú na konštantnej úrovni – ich množstvo sa napriek kontinuálnej reakcii nemení. V chemickom rovnovážnom stave sú reakčné rýchlosti v oboch smeroch rovnaké. Chemická rovnováha za určitých podmienok znamená najstabilnejší stav pre konkrétny systém. Spotreba energie je potom veľmi nízka. Chemická rovnovážna konštanta K je koeficient, ktorý popisuje rovnováhu dvoch reverzibilných reakcií. Je definovaný ako podiel koncentrácií produktov a substrátov zvýšených na mocniny zodpovedajúce stechiometrickým koeficientom, ktoré boli namerané v chemickom rovnovážnom stave. Vzorec pre konštantu bol odvodený v roku 1864 ako takzvaný zákon hromadnej akcie. Malo by sa pamätať na to, že ide o charakteristickú hodnotu pre konkrétnu reakciu. Na stav chemickej rovnováhy vplýva množstvo faktorov. Toto sú niektoré z nich:
- teplota,
- objem reakčného systému,
- tlak,
- koncentrácia reaktantov.
Čo je dôležité, poloha rovnovážneho stavu nie je ovplyvnená pridaním alebo zmenou reakčného katalyzátora. Jeho úlohou je len skrátiť čas, počas ktorého sa dosiahne rovnováha. 
Le Chatelierov princíp (zákon rovnováhy)
Zmenou určitých reakčných podmienok môžeme ovplyvniť jeho rovnováhu. Systém sa bude vždy snažiť udržiavať rovnováhu, pretože je to preň energeticky priaznivé (najnižší výdaj energie). V dôsledku toho dôjde k zmenám pôsobiacim proti faktorom, ktoré vychýlia systém z rovnováhy. Tento jav bol vysvetlený v roku 1881 a dnes je známy ako Le Chatelier-Braunov princíp alebo ako zákon rovnováhy. Umožňuje pochopiť odozvu systému na zmeny podmienok reakcie, ktorá je v stave chemickej rovnováhy. Prídavok jednej z reagujúcich látok do systému spôsobuje narušenie rovnováhy. Menia sa koncentrácie jednotlivých reaktantov. Aby sa tomu zabránilo, systém má tendenciu produkovať viac produktu (keď bol pridaný substrát) alebo rekonštituovať substrát (keď bolo pridané určité množstvo produktu). Zmena reakčnej teploty má obrovský vplyv najmä na endotermické a exotermické procesy. V prípade prvého je potrebné dodávať energiu do systému vo forme tepla, takže zvýšenie teploty celého procesu posunie rovnováhu doprava (zníženie doľava), smerom k tvorbe väčšieho množstva produktu. . Opačný prípad bude pri exotermických reakciách, kde jedným z produktov je teplo. Teplota nemá žiadny vplyv na rovnováhu reakcie, kde nie je pozorovaný žiadny tepelný účinok. V prípade reakcií prebiehajúcich v plynnej fáze je tlak veľmi dôležitým aspektom. Zvýšenie hodnoty tohto parametra, teda zníženie reakčného objemu systému, spôsobí posun reakčnej rovnováhy. Smer zmien závisí od stechiometrických koeficientov v reakčnej rovnici. Tento parameter neovplyvní chemickú rovnováhu reakcie, pri ktorej je súčet stechiometrických koeficientov plynných substrátov a produktov rovnaký. Stojí za to pripomenúť, že keď je systém vyhodený z chemickej rovnováhy, uplatní sa zákon rovnováhy a v dôsledku toho sa dosiahne nový rovnovážny stav.
