Elektronegativita je veličina, ktorá odráža tendenciu daného atómu v molekule priťahovať elektróny k sebe. V praxi ide o schopnosť atómu alebo funkčných skupín priťahovať elektrónovú hustotu. Najčastejšie používaná stupnica spojená s touto veličinou je tá, ktorú zaviedol Linus Pauling, ktorá umožňuje jednoducho vypočítať približnú povahu väzby.

Charakteristiky elektronegativity
Homonukleárne molekuly, napríklad H 2 a O 2 , majú vo svojich molekulových orbitáloch rovnaké koeficienty c A a c B , ktoré možno zaznamenať ako vlnové funkcie: Ψ +AB = c A Ψ A + c B Ψ B Ψ −AB = c A Ψ A − c B Ψ B V tomto prípade je orbitál charakteristický tým, že jeho tvar je symetrický vzhľadom na stred molekuly a jeho elektrický náboj je v ňom rovnako symetricky rozložený. Ďalším príkladom sú však heteronukleárne molekuly, v ktorých je prakticky nemožné zachovať rovnaké koeficienty, ako aj úplnú symetriu vzhľadom na stred molekuly. Keď je energetická hladina atómového orbitálu Ψ B nižšia ako energetická hladina atómového orbitálu Ψ A , nastáva vzťah a maximum hustoty pravdepodobnosti elektrónov sa posúva smerom k atómu B. V praxi to má za následok posun elektrónu pár v chemickej väzbe, tj polarizácia smerom k atómu B. Napríklad v molekule hydridu lítneho LiH je tento posun smerom k atómu vodíka, zatiaľ čo v molekule fluorovodíka HF k atómu fluóru. To znamená, že atóm vodíka má nižšiu energetickú hladinu ako lítium, ale vyššiu energetickú hladinu ako fluór (prečítajte si o halogénoch ). Za týchto podmienok jeden z atómov oboch molekúl preberá záporný náboj označený ako -δ a druhý je kladný +δ. Všeobecný vzorec takejto molekuly je A + 5 B – 5 .
Náboje atómov
Vyššie uvedený náboj δ môže nadobudnúť rôzne hodnoty v závislosti od prvkov viazaných chemickou väzbou . Jeho hodnota 0 znamená, že náboj elektrónového páru je rozložený symetricky a pár sa nachádza úplne v blízkosti atómu s nižšou energetickou hladinou, čo má za následok prenos oboch elektrónov na tento atóm. To vytvára iónovú väzbu medzi prvkami. V prevažnej väčšine chemických väzieb sú však zlomkové náboje, ktorých výsledkom je stav medzi kovalentnou a iónovou väzbou.
Dipólového momentu
Dipól je molekula, v ktorej možno rozlíšiť dva póly – kladný a záporný. Dipólový moment, označený μ, je mierou veľkosti posunu elektrického náboja v ňom. Je definovaný ako súčin absolútnej hodnoty elektrického náboja (δ) obsiahnutého v jednom z pólov a vzdialenosti od týchto pólov (l): μ = δ · l Kladný náboj (δ+) a záporný náboj ( δ-) sa nazýva čiastočný náboj a jeho umiestnenie sa pripisuje konkrétnemu atómu, ale v skutočnosti je to len väčšia alebo menšia pravdepodobnosť prítomnosti elektrónu okolo ich jadra. Takýto jav sa niekedy zamieňa s procesmi oxidácie a redukcie , ale na rozdiel od zmien, ktoré v nich prebiehajú, takéto náboje prijímané atómami nespôsobujú ich prechod do iného oxidačného stavu, takže medzi nimi nedochádza k výmene elektrónov. ich. Jednotkou SI na vyjadrenie dipólového momentu je coulomb meter (C·m). Vo výpočtoch sa však najčastejšie používa jednotka zapísaná v systéme CGS, debye (D). Jeden debye zodpovedá hodnote 3,33564·10 -30 C·m. Najväčší teoreticky možný dipólový moment charakterizuje molekuly s čisto iónovou väzbou. Zatiaľ čo najmenší sa vyskytuje v molekulách, ktorých väzba je čisto kovalentná – dipólový moment je v tomto prípade nulový. Väčšinou však ide o prechodné prípady s rôznym charakterom častíc.
Halogénový dipólový moment
Na špecifických chemických zlúčeninách možno ľahko pozorovať niekoľko vzťahov medzi elektronegativitou a dipólovým momentom. Tabuľka 1 Dipólové momenty halogenovodíkov
| Zlúčenina | Experimentálne určený dipólový moment [ μ, D] | Dĺžka väzby [pm] | Súčin elementárneho náboja a dĺžky dipólu [e ·l, D] | Podiel iónového znaku [ %] | Rozdiel v elektronegativite halogénu a vodíka |
| HF | 1,98 | 92 | 4.42 | 45 | 1.9 |
| HCl | 1.08 | 128 | 6.15 | 18 | 0,9 |
| HBr | 0,79 | 143 | 6,87 | 12 | 0,7 |
| AHOJ | 0,38 | 162 | 7,78 | 5 | 0,4 |
Pomer μ/(e·l’), tj skutočný dipólový moment k dipólovému momentu, ktorý zodpovedá iónovej väzbe, môže poskytnúť mieru odchýlok od plne kovalentnej väzby. Súčin tohto vzťahu vo forme (μ/(e·l’))·100 %predstavuje percento iónového charakteru vo väzbe. Je to len približná hodnota, keďže dipólový moment závisí nielen od polarity väzby, ale aj od správania voľných elektrónových párov. Stáva sa, že elektrónový oblak môže byť posunutý von z molekuly, čo má za následok, že rovnica na určenie jeho dipólového momentu má ďalšiu zložku. V prípade molekuly amoniaku je oblak nasmerovaný v súlade s dipólovým momentom väzby, čo vedie k zvýšeniu výsledného dipólového momentu. Naopak, opak je pravdou pre molekulu oxidu uhoľnatého, kde je oblak nasmerovaný opačným smerom a následne znižuje výsledný dipólový moment. 
Elektronegativita
Je to bezrozmerná empirická veličina, ktorá odráža tendenciu daného atómu v molekule priťahovať elektróny k sebe. V praxi ide o schopnosť atómu alebo funkčných skupín priťahovať elektrónovú hustotu. Najčastejšie používaná stupnica spojená s touto veličinou je tá, ktorú zaviedol Linus Pauling, ktorá umožňuje jednoducho vypočítať približnú povahu väzby. Na výpočet elektronegativity jednotlivých prvkov použil vedec nasledujúcu metódu: Predpokladáme, že D AA a D BB sú väzbové energie dvojatómových molekúl (A 2 , B 2 ). Väzbovú energiu, ktorá sa vyskytuje v molekule, označujeme ako D AB . Empiricky sa ukázalo, že ak takáto väzba obsahuje malý alebo žiadny iónový charakter, rozdiel medzi hodnotami D AB a geometrickým priemerom energetických hodnôt D AA a D BB je rovný alebo blízky nule. Keď má AB väzba jasné odchýlky od kovalentného charakteru, tento rozdiel nadobudne kladné hodnoty, ktoré sa zvyšujú so zvyšujúcim sa podielom iónového charakteru. Rozdiel medzi elektronegativitou (x) dvoch atómov zapojených do väzby je vyjadrený vzorcom: ![]() Ak teda Pauling vo svojich výpočtoch predpokladal elektronegativitu fluóru 4,0, je možné vypočítať následné elektronegativity prvkov. Ak poznáme hodnotu x A atómov prvku A a hodnotu koeficientu Δ’, potom môžeme pomocou vyššie uvedenej rovnice vypočítať hodnotu x B. Paulingova stupnica je konštruovaná tak, že jej hodnoty približne súhlasia s hodnotami dipólového momentu väzby tvorenej uvažovanými atómami, ako vidíme na príklade v tabuľke 1, ktorý obsahuje hodnoty určené pre halogenovodíky. . Okrem vyššie opísanej stupnice je vo vedeckej literatúre opísaných niekoľko ďalších, vrátane elektronegativity opísanej:
Ak teda Pauling vo svojich výpočtoch predpokladal elektronegativitu fluóru 4,0, je možné vypočítať následné elektronegativity prvkov. Ak poznáme hodnotu x A atómov prvku A a hodnotu koeficientu Δ’, potom môžeme pomocou vyššie uvedenej rovnice vypočítať hodnotu x B. Paulingova stupnica je konštruovaná tak, že jej hodnoty približne súhlasia s hodnotami dipólového momentu väzby tvorenej uvažovanými atómami, ako vidíme na príklade v tabuľke 1, ktorý obsahuje hodnoty určené pre halogenovodíky. . Okrem vyššie opísanej stupnice je vo vedeckej literatúre opísaných niekoľko ďalších, vrátane elektronegativity opísanej:
- Mulliken, ktorého práca predpokladala, že elektronegativita prvku je priamo úmerná súčtu jeho elektrónovej afinity a ionizačnej energie. Elektrónová afinita, čo je množstvo energie, ktorá sa uvoľní v dôsledku pripojenia elektrónu k neutrálnemu atómu, a ionizačná energia rovná množstvu energie potrebnej na oddelenie elektrónu od neutrálneho atómu. Najvyššie elektronegativity sú preto charakteristické pre atómy, ktoré vykazujú vysokú elektrónovú afinitu a vysokú ionizačnú energiu.
- Allred a Rochow, ktorí predpokladali úmernosť elektronegativity k miere sily, ktorou atómové jadro (Z) pôsobí na valenčné elektróny, zaznamenané ako
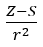 (r – atómový polomer, S – skríningová konštanta). Podľa ich teórie možno elektronegativitu (x) prvkov vypočítať pomocou vzorca:
(r – atómový polomer, S – skríningová konštanta). Podľa ich teórie možno elektronegativitu (x) prvkov vypočítať pomocou vzorca:
![]() Na každej stupnici sa elektronegativita vodíka blíži k hodnote 2,2, pričom ostatné hodnoty sa mierne líšia. Príklady elektronegativít elementárnych atómov vypočítaných podľa Paulingovej, Mullikenovej a Allredovej a Rochowovej stupnice sú uvedené v tabuľke 2 nižšie. Tabuľka 2 Elektronegativity vzorových prvkov na Paulingovej (P), Mullikenovej (M) a Allredovej a Rochowovej (AR) stupnici
Na každej stupnici sa elektronegativita vodíka blíži k hodnote 2,2, pričom ostatné hodnoty sa mierne líšia. Príklady elektronegativít elementárnych atómov vypočítaných podľa Paulingovej, Mullikenovej a Allredovej a Rochowovej stupnice sú uvedené v tabuľke 2 nižšie. Tabuľka 2 Elektronegativity vzorových prvkov na Paulingovej (P), Mullikenovej (M) a Allredovej a Rochowovej (AR) stupnici
| Atom | P | M | AR |
| F | 3,98 | 3,90 | 4.10 |
| O | 3.44 | 3.04 | 3,50 |
| N | 3.04 | 2.28 | 3.07 |
| Cl | 3.16 | 2,95 | 2.83 |
| C | 2.55 | 1,75 | 2,50 |
| H | 2.20 | 2.21 | 2.20 |
| Si | 1,90 | 2.25 | 1,74 |
| F | 0,82 | 0,77 | 0,91 |
| Rb | 0,82 | 0,50 | 0,89 |
| Čs | 0,79 | – | 0,86 |
| Fr | 0,70 | – | 0,86 |
Napriek nezrovnalostiam vo výpočtoch s týmito tromi metódami má fluór najvyššiu elektronegativitu v každej škále, za ním nasleduje kyslík, dusík a chlór . Najnižšie hodnoty boli stanovené pre francium, cézium, rubídium a draslík. Prvky, ktoré sú typicky nekovy, majú elektronegativitu vyššiu ako 2, typické kovy majú elektronegativitu nižšiu ako 2. Štandardná hodnota je už spomínaná elektronegativita vodíka približne 2,2. 
Elektronegativita v periodickej tabuľke
Rovnako ako mnohé iné vlastnosti, aj elektronegativita sa odráža v usporiadaní chemických prvkov v periodickej tabuľke . V skupine elektronegativita klesá s narastajúcim počtom škrupín a kovovým charakterom, teda stúpa smerom od francia k vodíku. Postupom času sa elektronegativita zvyšuje s nárastom prítomných valenčných elektrónov a poklesom nekovového charakteru, takže od kovov k vzácnym plynom .
Elektronegativita a typ väzby – zhrnutie
Poznaním jednotlivých hodnôt elektronegativity prvkov tvoriacich chemickú väzbu vieme odvodiť jej povahu. Ak je rozdiel medzi 0,0 a 0,4, väzba je kovalentná. Keď je rozdiel medzi 0,4 a 1,7, väzba je polarizovaná kovalentná. Rozdiel nad 1,7 v elektronegativite prvkov naznačuje iónovú väzbu.
