Disociácia v chemickom kontexte znamená rozklad látky na iné molekuly. Slovo pochádza z latinského výrazu „ dissociatio “, čo znamená „oddelenie“. Vo vedeckej nomenklatúre má disociácia rôzne definície, keďže má svoj špecifický význam aj v psychológii. Zamerajme sa však na to, čo znamená disociácia v chémii. Podľa priebehu procesu a použitej látky rozoznávame štyri rôzne typy disociácie. Najpopulárnejšia je elektrolytická disociácia, hoci tepelná disociácia je rovnako dôležitá.

Tepelná disociácia
Proces spočíva v rozklade molekúl na menšie molekuly alebo na atómy pod vplyvom teploty. Najdôležitejším vzťahom je skutočnosť, že teplota použitá na disociáciu môže byť nižšia, ak zlúčenina obsahuje slabšie chemické väzby. Tie s vyššou energiou potrebnou na rozklad vyžadujú vyššiu teplotu. Bežným príkladom termolýzy (tepelnej disociácie) je karamelizácia sacharózy, ku ktorej dochádza pri 160 o C.
Elektrolytická disociácia
Objavil ho v roku 1887 švédsky chemik Svante Arrhenius a je o niečo zložitejší v porovnaní s tepelnou disociáciou. Elektrolytická disociácia spočíva v rozklade látky, ku ktorému dochádza, keď rozpúšťadlo (zvyčajne voda) ovplyvňuje voľne sa pohybujúce ióny. Arrhenius vo svojom výskume dokázal, že ióny produkované takouto disociáciou spôsobujú, že roztok vedie elektrický prúd. To bol základ pre rozvoj klasifikácie chemických látok na elektrolyty (roztoky schopné viesť elektrický prúd) a neelektrolyty (roztoky, ktoré nie sú schopné viesť elektrický prúd).
Elektrolyty
Pojem „elektrolyty“ má dva významy – z technického hľadiska ide o akúkoľvek látku, ktorá môže iónovo prenášať náboj medzi elektródami. V dôsledku toho môže iónovo viesť elektrický prúd. Iný, chemickejší význam tohto výrazu sa týka látok, ktoré podliehajú elektrolytickej disociácii v dôsledku topenia alebo rozpúšťania. Takéto roztoky (najčastejšie vodné) vedú aj elektrický prúd. Príklady takýchto elektrolytov zahŕňajú iónové zlúčeniny, ako je chlorid sodný (stolová soľ), ale aj neiónové zlúčeniny, napríklad kyselinu chlorovodíkovú alebo hydroxid draselný . Vzhľadom na ich špecifické vlastnosti možno elektrolyty nazvať elektrickými vodičmi. Tieto možno rozdeliť na vodiče triedy 1 (kovy, ich zliatiny a uhlík) a vodiče triedy 2 (roztoky zásad, kyselín a solí ).
Mechanizmus elektrolytickej disociácie
V rozpúšťadle, ktorého dielektrická konštanta je vysoká (napr. 81 pre vodu), sú sily vzájomnej príťažlivosti medzi iónmi v kryštalickej sieti značne znížené. Vtedy dochádza k odlomeniu iónov, čo spôsobí rozpustenie látky a uvoľnenie voľne sa pohybujúcich iónov do roztoku. K takýmto procesom dochádza aj v dôsledku interakcie medzi iónmi a molekulami vody, čo je dôsledok polárnej štruktúry H 2 O. Mechanizmus účinku vody podľa Nekrasova pri rozklade elektrolytu s iónovou štruktúrou spúšťa tzv. kladný ión látky, ktorý priťahuje opačný pól molekuly vody a zároveň odtláča kladný ión. Opačný pól pôsobí rovnakým spôsobom a oba ióny sú obklopené molekulami vody, ktoré priťahujú. Takáto príťažlivosť sa vyskytuje v oboch smeroch medzi dipolárnymi molekulami a iónmi, čo spôsobuje, že príťažlivá sila iónov v elektrolyte je oveľa nižšia. Mechanizmus teda možno rozdeliť do štyroch základných etáp: prechod polárnej na iónovú štruktúru, vytvorenie iónovej štruktúry a hydratácia iónov. Väzby medzi iónmi a rozpúšťadlom, ktoré vznikajú disociáciou, sa nazývajú solváty. Ak je rozpúšťadlom voda, potom sa nazývajú hydráty.
Hydratačný obal
Je to obal zložený z molekúl vody existujúcich v tesnej blízkosti iónu, orientovaných svojimi opačnými pólmi. Voľné, nabité póly priťahujú ďalšie vodné vrstvy, kým sa príťažlivá sila iónu nestane slabšou ako molekulárna pohybová energia v roztoku. Plášť uľahčuje rozklad molekúl elektrolytu na katióny a anióny a tvorí bariéru, ktorá bráni opätovnému spájaniu iónov za vzniku molekúl. 
Disociácia kyselín a zásad: zákon hromadného pôsobenia
Silné kyseliny sú kyseliny, ktoré vykazujú ďalekosiahlu disociáciu vo vodnom roztoku a slabé kyseliny sú tie, ktoré disociujú len v malom rozsahu. Ak porovnávame silu rôznych kyselín, mali by sme vziať do úvahy aj niekoľko faktorov, ako je tendencia molekúl kyseliny rozdávať svoje protóny alebo koncentrácia príslušnej látky. Existuje však chemická hodnota, ktorá nezávisí od koncentrácie, ale vynikajúco charakterizuje jednotlivé vlastnosti molekúl – disociačná konštanta. Odvodenie rovnice pre túto hodnotu by sa malo začať napísaním rovnice pre disociáciu kyseliny . Napríklad s jedným protónom (HX) to bude vyzerať takto: ![]() Ak je roztok zriedený a kyselina je slabá, môžeme použiť zákon hmotnostného pôsobenia, ktorý je vyjadrený takto:
Ak je roztok zriedený a kyselina je slabá, môžeme použiť zákon hmotnostného pôsobenia, ktorý je vyjadrený takto: 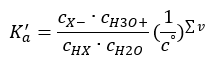 Existujú dva spôsoby, ako skrátiť prezentovaný vzťah. Prvým krokom je predpokladať, že koncentrácia vody je konštantná. Symbol c o môžeme tiež vynechať, pretože vyjadruje štandardnú koncentráciu rovnajúcu sa 1 mol/dm 3 . Je však dôležité umiestniť ho do počiatočného vzorca a zohľadniť ho pri určovaní jednotky. Chemické konštanty sú totiž bezrozmerné hodnoty. Medzitým sú všetky koncentrácie použité vo vzorci vyjadrené v mol/dm3 . Potom nakoniec získame vzorec pre disociačnú konštantu:
Existujú dva spôsoby, ako skrátiť prezentovaný vzťah. Prvým krokom je predpokladať, že koncentrácia vody je konštantná. Symbol c o môžeme tiež vynechať, pretože vyjadruje štandardnú koncentráciu rovnajúcu sa 1 mol/dm 3 . Je však dôležité umiestniť ho do počiatočného vzorca a zohľadniť ho pri určovaní jednotky. Chemické konštanty sú totiž bezrozmerné hodnoty. Medzitým sú všetky koncentrácie použité vo vzorci vyjadrené v mol/dm3 . Potom nakoniec získame vzorec pre disociačnú konštantu: 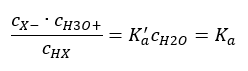 Vzťah vyjadrujúci kyslú disociačnú konštantu (Ka) pozostáva z experimentálne stanovených hodnôt, ktoré spadajú do rozsahu 10-10 až 108 . Obľúbenou operáciou je použitie logaritmického vzorca vyjadreného ako záporný logaritmus disociačnej konštanty, označený ako pKa : pKa = -logKa Je dôležité, že kým nízke hodnoty K a predstavujú slabé kyseliny, vysoké hodnoty predstavujú silné kyseliny. , pKa sa mení opačne. Nízke, zvyčajne negatívne hodnoty pKa zodpovedajú silným kyselinám. Pozitívne, vysoké hodnoty pKa predstavujú slabé kyseliny. Keď zavedieme ďalší pojem, stupeň disociácie (α), čo je pomer počtu mólov molekúl danej zlúčeniny, ktoré podliehajú disociácii (rozkladu na ióny), k celkovému počtu mólov molekúl danej zlúčeniny. že zlúčenina prítomná v roztoku, môžeme rovnicu ďalej rozvíjať. Ak odhliadneme od veľmi nízkej koncentrácie vodíkových iónov vytvorených disociáciou vody a použijeme rovnovážne koncentrácie iónov a molekúl, môžeme predpokladať, že:
Vzťah vyjadrujúci kyslú disociačnú konštantu (Ka) pozostáva z experimentálne stanovených hodnôt, ktoré spadajú do rozsahu 10-10 až 108 . Obľúbenou operáciou je použitie logaritmického vzorca vyjadreného ako záporný logaritmus disociačnej konštanty, označený ako pKa : pKa = -logKa Je dôležité, že kým nízke hodnoty K a predstavujú slabé kyseliny, vysoké hodnoty predstavujú silné kyseliny. , pKa sa mení opačne. Nízke, zvyčajne negatívne hodnoty pKa zodpovedajú silným kyselinám. Pozitívne, vysoké hodnoty pKa predstavujú slabé kyseliny. Keď zavedieme ďalší pojem, stupeň disociácie (α), čo je pomer počtu mólov molekúl danej zlúčeniny, ktoré podliehajú disociácii (rozkladu na ióny), k celkovému počtu mólov molekúl danej zlúčeniny. že zlúčenina prítomná v roztoku, môžeme rovnicu ďalej rozvíjať. Ak odhliadneme od veľmi nízkej koncentrácie vodíkových iónov vytvorených disociáciou vody a použijeme rovnovážne koncentrácie iónov a molekúl, môžeme predpokladať, že: 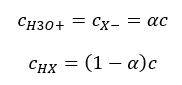 Potom možno disociačnú konštantu zaznamenať takto:
Potom možno disociačnú konštantu zaznamenať takto:  V tejto forme je to závislosť stupňa disociácie elektrolytu od jeho koncentrácie, tj Ostwaldov zákon riedenia. Ak analyzujeme veľmi slabé elektrolyty, stupeň disociácie (α) možno predpokladať ako <<1 a vzorec možno zjednodušiť na nasledovné:
V tejto forme je to závislosť stupňa disociácie elektrolytu od jeho koncentrácie, tj Ostwaldov zákon riedenia. Ak analyzujeme veľmi slabé elektrolyty, stupeň disociácie (α) možno predpokladať ako <<1 a vzorec možno zjednodušiť na nasledovné:  Kyseliny, ktoré obsahujú viac ako jeden protón, prechádzajú viacstupňovou disociáciou a musíme brať do úvahy všetky jej stupne. Aby sme uviedli príklad, pre kyselinu ortofosforečnú existujú tri stupne:
Kyseliny, ktoré obsahujú viac ako jeden protón, prechádzajú viacstupňovou disociáciou a musíme brať do úvahy všetky jej stupne. Aby sme uviedli príklad, pre kyselinu ortofosforečnú existujú tri stupne:
- H3P04 + H20 = H2P04- + H30 +
- H2P04- + H20 = HPO42- + H30 +
- HP042- + H20 = P043- + H30 +
Každý stupeň má svoju vlastnú rovnovážnu konštantu, ktorú možno zaznamenať analogicky ako v prvom:  Disociačné konštanty sú uvedené v tabuľkách, a to ako pre hydráty, tak aj pre kyslé kyseliny.
Disociačné konštanty sú uvedené v tabuľkách, a to ako pre hydráty, tak aj pre kyslé kyseliny.
| Kyselina | K a | pK a |
| HF | 6,3· 10-4 | 3.2 |
| HCl | 1·10 7 | -7 |
| HNO 3 | 27,54 | -1,44 |
| H3PO4 _ | 6,9· 10-3 | 2.16 |
Tabuľka 1. Príklady hodnôt disociačných konštánt pre kyseliny. Podobne je to aj pri stabilizácii rovnováhy báz pri disociácii. Ak vezmeme do úvahy vzorové pravidlo B, rovnicu možno zaznamenať takto: ![]() Potom, ak chceme odvodiť disociačnú konštantu pre bázu pomocou zákona o pôsobení hmoty a za predpokladu, že koncentrácia vody v zriedenom roztoku je prakticky konštantná, dostaneme nasledujúci vzorec:
Potom, ak chceme odvodiť disociačnú konštantu pre bázu pomocou zákona o pôsobení hmoty a za predpokladu, že koncentrácia vody v zriedenom roztoku je prakticky konštantná, dostaneme nasledujúci vzorec:  Čím silnejšia je báza, tým vyššia je disociačná konštanta a nižšia hodnota pKb , pričom čím nižšia je disociačná konštanta a čím vyššia je hodnota pKb , tým je báza slabšia.
Čím silnejšia je báza, tým vyššia je disociačná konštanta a nižšia hodnota pKb , pričom čím nižšia je disociačná konštanta a čím vyššia je hodnota pKb , tým je báza slabšia.
| Základňa | K b | pK b |
| Hydrazín | 3· 10-6 | 5.5 |
| Amoniak | 1,78-10-5 | 4,75 |
| metylamín | 5,0· 10-4 | 3.3 |
Tabuľka 2. Príklady hodnôt disociačných konštánt pre bázy. 
Čo určuje silu kyselín
Ak poznáme vyjadrenia disociačných konštánt pre konkrétne kyseliny, môžeme urobiť niekoľko pravdivých predpokladov:
- Sila hydrátu sa zvyšuje spolu so zvyšujúcim sa atómovým číslom prvku spojeného s atómom vodíka.
- Sila hydrátu klesá spolu so zvyšujúcou sa elektronegativitou prvku pripojeného k atómu vodíka. To môže byť zavádzajúce, pretože teoreticky by rastúca elektronegativita mala uprednostňovať abstrakciu protónov.
- Veľkosť aniónu vzniknutého pri disociácii ovplyvňuje disociačnú konštantu vo väčšej miere ako elektronegativita.
Samovoľná disociácia vody
Zaujímavým príkladom disociácie je rozklad molekúl vody. Keďže sú schopné protóny čerpať aj odovzdávať, čistá voda podlieha v malom rozsahu samovoľnej disociácii podľa nasledujúcej rovnice: H 2 O + H 2 O ↔ H 3 O + + OH – Podobne ako kyseliny a báz, je možné aplikovať aj zákon hromadného pôsobenia, ktorý zahŕňa rovnovážne koncentrácie nedisociovanej vody, ako aj jej aniónov a katiónov: 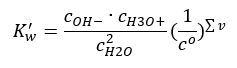 Ukazuje sa, že koncentrácie katiónov H 3 O + a OH – aniónov sú v porovnaní s nedisociovanou vodou také malé, že ani ich alterácia prakticky nemení koncentráciu nedisociovanej vody. To umožňuje predpokladať, že hodnota je konštantná a previesť rovnicu do nasledujúceho tvaru: K w = c OH – · c H3O + Je to obzvlášť dôležitý aspekt v kontexte chemických výpočtov a takáto konštanta sa označuje až ako iónový produkt vody. Často sa používa aj ako záporný logaritmus, označený ako pKw . To sa rovná –logK w . Na základe rovnice, ak je iónová rovnováha vody narušená v dôsledku dodávania iónov H 3 O + , potom na udržanie stálosti iónového produktu musíme znížiť koncentráciu iónov OH – . Podobne nadbytok OH – iónov znižuje koncentráciu katiónov. Súčin týchto koncentrácií musí byť konštantný. Experimenty ukázali, že Kw pri teplote 298 K je 10-14 . Preto si môžeme všimnúť aj rovnicu platnú pre čistú vodu takto:
Ukazuje sa, že koncentrácie katiónov H 3 O + a OH – aniónov sú v porovnaní s nedisociovanou vodou také malé, že ani ich alterácia prakticky nemení koncentráciu nedisociovanej vody. To umožňuje predpokladať, že hodnota je konštantná a previesť rovnicu do nasledujúceho tvaru: K w = c OH – · c H3O + Je to obzvlášť dôležitý aspekt v kontexte chemických výpočtov a takáto konštanta sa označuje až ako iónový produkt vody. Často sa používa aj ako záporný logaritmus, označený ako pKw . To sa rovná –logK w . Na základe rovnice, ak je iónová rovnováha vody narušená v dôsledku dodávania iónov H 3 O + , potom na udržanie stálosti iónového produktu musíme znížiť koncentráciu iónov OH – . Podobne nadbytok OH – iónov znižuje koncentráciu katiónov. Súčin týchto koncentrácií musí byť konštantný. Experimenty ukázali, že Kw pri teplote 298 K je 10-14 . Preto si môžeme všimnúť aj rovnicu platnú pre čistú vodu takto:  Disociácia tiež súvisí s hodnotou pH roztoku. Roztoky s rovnakými koncentráciami katiónov H 3 O + a OH – aniónov vykazujú neutrálne pH. V kyslých roztokoch je koncentrácia katiónov vyššia ako 10 -7 mol/l, zatiaľ čo v alkalických roztokoch je nižšia ako 10 -7 mol/l.
Disociácia tiež súvisí s hodnotou pH roztoku. Roztoky s rovnakými koncentráciami katiónov H 3 O + a OH – aniónov vykazujú neutrálne pH. V kyslých roztokoch je koncentrácia katiónov vyššia ako 10 -7 mol/l, zatiaľ čo v alkalických roztokoch je nižšia ako 10 -7 mol/l.
