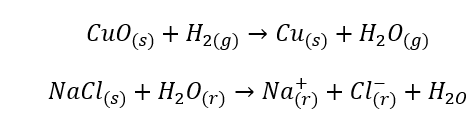Úvahy o rôznych javoch a procesoch musia byť viacvrstvové. Mali by sme brať do úvahy mikroskopické aj makroskopické vlastnosti. Ako už názov napovedá, toto rozdelenie sa robí oddelením rádovo analyzovaných položiek. Makroskopická doména, úzko spätá s termodynamikou chemických reakcií, nám umožňuje pozorovať a merať fyzikálne a chemické vlastnosti, ako je hustota, teplota alebo rozpustnosť. Mikroskopickou analýzou môžeme pozorovať pohyby a interakcie molekúl. Molekuly môžeme opísať z hľadiska ich rýchlosti a kinetickej energie. Ak nás zaujíma zmes, môžeme brať do úvahy jej homogenitu a následne aj typ systému, v ktorom existuje.

Klasifikácia fyzikálno-chemických systémov
Pri analýze homogenity materiálových systémov ich makroskopická škála klasifikuje do dvoch základných skupín: homogénne a heterogénne systémy. Táto kategorizácia je založená na ich fyzikálnych vlastnostiach: fyzikálnom stave, rozpustnosti a teplote topenia, ktoré sa môžu alebo nemusia líšiť. Každý systém zahŕňa všetky látky, ktoré sa zúčastňujú konkrétnej reakcie alebo procesu. Časť systému, ktorá jednoznačne vyniká zachovaním rovnakých vlastností, sa označuje ako fáza. Existujú tri rôzne typy fáz: tuhá, kvapalná a plynná. Povrch nachádzajúci sa medzi nimi a zvyškom systému sa nazýva rozhranie. V závislosti od voľnej entalpie (ΔG) alebo entropie (ΔS), ak ΔS>0 alebo ΔG<0, môže premena jednej fázy na druhú prebiehať automaticky.
Diagram fázovej rovnováhy
Grafické znázornenie existencie rôznych fáz sa nazýva diagram fázovej rovnováhy. Zahŕňa existenciu špecifických fáz (ak sa dosiahnu určité teplotné a tlakové rozsahy) a ich vzájomné premeny. Schematický diagram fázovej rovnováhy pre jednozložkový systém ilustruje existenciu troch hlavných fáz v závislosti od podmienok procesu. Čiary, ktoré zobrazuje, označujú stavy rovnováhy medzi dvoma príslušnými fázami, to znamená medzi pevnou látkou a plynom, medzi pevnou látkou a kvapalinou a medzi plynom a kvapalinou. Ak teda poznáme jeden z kritických parametrov, môžeme určiť podmienky, ktoré spôsobia topenie, mrazenie, vyparovanie, kondenzáciu, sublimáciu alebo resublimáciu príslušnej zložky. Okrem toho diagram obsahuje trojitý bod, kde sa všetky fázové vedenia spájajú, čo naznačuje, že všetky tri fázy môžu existovať za určitých podmienok súčasne. Diagram tiež obsahuje dva dôležité body: kritický tlak a kritickú teplotu. Kritický tlak udáva bod predstavujúci maximálny tlak, pri ktorom môžeme premeniť kvapalinu na plyn, alebo maximálny možný tlak nasýtenej pary nad kvapalinou. Pojem kritická teplota definuje najvyššiu teplotu, pri ktorej môže plyn kondenzovať pri zvyšovaní tlaku. Preto kritický bod existujúci pri kritických teplotných a kritických tlakových podmienkach definuje stav, v ktorom nie je možné rozlíšiť kvapalnú a plynnú fázu.
Gibbsovo fázové pravidlo
Je to špecifický vzťah, ktorý možno aplikovať na akýkoľvek systém existujúci v termodynamickej rovnováhe. Rovnica predstavujúca toto pravidlo obsahuje počet fáz (f) prítomných v systéme s počtom nezávislých zložiek (n) a počtom stupňov voľnosti (s). Číslo s zodpovedá množstvu nastaviteľných intenzívnych veličín, ktoré pri zmene nenarušia počet fáz v rovnováhe izolovanej sústavy. Intenzívne premenné sú akékoľvek fyzikálne hodnoty, ktoré v žiadnom prípade nezávisia od systému (napr. geometrické veľkosti alebo objem) alebo od počtu jeho molekúl, jeho hmotnosti, špecifického tepla atď. Rovnica je nasledovná: Nezávislé zložky systému , označené ako n, prakticky predstavujú najnižší počet komponentov systému potrebný na vybudovanie každej z jeho fáz v akomkoľvek množstve. Ak analyzujeme systém, ktorého komponenty môžu navzájom reagovať, vypočítame hodnotu n odčítaním počtu nezávislých reakčných rovníc od celkového počtu komponentov, ktoré tvoria systém. Ak teda predpokladáme nasledujúci zápis: ![]() počet nezávislých rovníc je 1 – skúmame konkrétnu reakciu, ktorá sa v systéme vyskytuje. Nezávislá rovnica je akýkoľvek systém chemických rovníc, v ktorom nie je možné získať žiadnu z nich kombináciou ostatných. Zatiaľ čo počet komponentov pre takýto systém je 3: sú to CaC03 , CaO a CO2 . Táto informácia nám umožňuje vypočítať aj počet nezávislých komponentov: n = počet komponentov – počet nezávislých rovníc, a teda: n = 3 – 1 = 2 Rovnaký príklad môžeme použiť na výpočet počtu stupňov voľnosti. pomocou rovnice pre Gibbsovo fázové pravidlo: s = n – f + 2 = 2 – 3 + 2 = 1 Táto hodnota naznačuje, že na udržanie stabilného množstva fáz v rovnováhe systému môžeme prevádzkovať iba jednu intenzívnu premennú.
počet nezávislých rovníc je 1 – skúmame konkrétnu reakciu, ktorá sa v systéme vyskytuje. Nezávislá rovnica je akýkoľvek systém chemických rovníc, v ktorom nie je možné získať žiadnu z nich kombináciou ostatných. Zatiaľ čo počet komponentov pre takýto systém je 3: sú to CaC03 , CaO a CO2 . Táto informácia nám umožňuje vypočítať aj počet nezávislých komponentov: n = počet komponentov – počet nezávislých rovníc, a teda: n = 3 – 1 = 2 Rovnaký príklad môžeme použiť na výpočet počtu stupňov voľnosti. pomocou rovnice pre Gibbsovo fázové pravidlo: s = n – f + 2 = 2 – 3 + 2 = 1 Táto hodnota naznačuje, že na udržanie stabilného množstva fáz v rovnováhe systému môžeme prevádzkovať iba jednu intenzívnu premennú. 
Heterogénne systémy
Akýkoľvek systém, ktorý obsahuje viac ako jednu fázu (teda nehomogénny systém), je tiež heterogénny. Typ fáz je irelevantný; heterogénny systém môže súčasne obsahovať niekoľko pevných a kvapalných fáz, ale iba jednu plynnú fázu. Je to spôsobené tým, že plyny sa dokonale miešajú. Zaujímavým príkladom heterogénneho systému je žula – obsahuje veľa pevných fáz, vrátane kremeňa, draselného živca, plagioklasu a biotitu. Mnohé potravinárske výrobky možno nazvať aj heterogénnymi, dokonalými príkladmi sú viaczložkové müsli alebo šalátové omáčky, ktoré pozostávajú z tuku, korenia a iných prísad. Zaujímavým typom nehomogénnych zmesí sú koloidy (roztoky, ktorých zložky sa dajú rozlíšiť len mikroskopom). Vo väčšine prípadov sa však dajú oddeliť jednoduchými metódami alebo nástrojmi. Napríklad na oddelenie zmesi zloženej z vody a oleja môžeme použiť dekantáciu – zložky budú viditeľné voľným okom. Ďalšie metódy, ktoré môžeme použiť na efektívne oddelenie nehomogénnych zmesí, zahŕňajú: filtráciu, mechanickú segregáciu alebo centrifugáciu. Podobne je to so zmesou minerálov, ktoré sa líšia vlastnosťami: kremeň, sľuda a živec sa dajú oddeliť aj kladivom.
Homogénne systémy
Na rozdiel od heterogénnych systémov je homogénny systém charakterizovaný prítomnosťou iba jednej fázy. V takom prípade nedokážeme rozlíšiť zložky voľným okom. Jednoduché metódy separácie sú tiež neúčinné a ako užitočné sa môžu ukázať iba metódy založené na fyzikálnych vlastnostiach. Príkladom takejto metódy je separácia destiláciou, ktorá je založená na diverzifikovaných bodoch varu špecifického systému. Ďalšími metódami účinnými pri separácii homogénnych zmesí sú kryštalizácia a chromatografia. Špeciálnym typom homogénneho systému je čistá látka, ktorej jediná fáza obsahuje iba jednu zložku. Ďalším príkladom sú všetky typy homogénnych roztokov a zmesí – napriek prítomnosti iba jednej fázy môže systém obsahovať veľa komponentov. Pretože fáza prítomná v systéme môže byť kvapalina, pevná látka alebo plyn, roztoky môžu mať tiež takéto formy. Príkladmi takýchto systémov sú kvapalné zmesi (ocot, voda), plynné zmesi (atmosférický vzduch) a tuhé zmesi, vrátane minerálnych rúd a všetkých druhov zliatin, ako je bronz alebo mosadz.
Prechody v systémoch
V systémoch sa môžu vyskytnúť dva typy prechodov, ktorými sú fázové (niekedy nazývané fyzikálne) a chemické prechody. Prvé zahŕňajú všetky prechody, ktoré nevytvárajú nové chemické látky. Tiež sa nevyznačujú vyblednutím už prítomných komponentov. Ako však naznačuje názov, vedú k takýmto zmenám v štruktúre alebo fyzickom stave. Je tiež možné, že sa vytvorí nová fáza, zatiaľ čo pôvodná fáza zanikne. Príklady fázových prechodov zahŕňajú resublimáciu a polymorfné prechody prvkov. Chemické prechody vykazujú úplne iný mechanizmus. Ide o reakcie, pri ktorých vznikajú nové látky, ktoré nahrádzajú pôvodné zložky. Takéto prechody sa môžu uskutočňovať v dvoch variantoch, napríklad počas hydrolýzy v jednej alebo viacerých fázach, ako aj počas horenia.
Chemické reakcie
- K homogénnym reakciám dochádza, keď je celý systém vrátane substrátov a produktov v jednej fáze, napríklad:
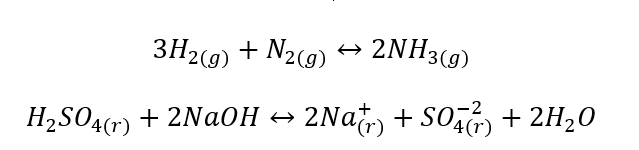
- Heterogénne reakcie sú také reakcie, pri ktorých je systém, vrátane substrátov a produktov, aspoň v dvoch rôznych fázach. Takéto reakcie sa vždy vyskytujú na rozhraní, napríklad: