V chémii niektoré chemické zlúčeniny vytvárajú špeciálne väzby s molekulami vody. Nejde o chemické väzby, ale o interakcie krátkeho dosahu, ktoré špecificky určujú vlastnosti týchto zlúčenín. Hovoríme o hydrátoch. Ich vlastnosti sa ľahko využívajú vo vybraných priemyselných odvetviach. Najobľúbenejšou hydratovanou soľou je nepochybne sadra, čiže dihydrát síranu vápenatého (VI), ktorý je dôležitou surovinou v stavebníctve. Hydráty sú tiež veľmi dobrými indikátormi obsahu vlhkosti. Súvisí to so skutočnosťou, že farba bezvodej soli je často odlišná od farby hydratovanej soli.

Hydratuje
Hydráty nie sú chemické zlúčeniny, v ktorých sa medzi molekulami vody a molekulami danej soli vyskytujú chemické väzby , napríklad kovalentné väzby . Nie sú to ani koordinačné zlúčeniny. Pre tieto štruktúry je charakteristické vytváranie vodíkových väzieb, ktoré sú oveľa slabšie ako chemické väzby. Hydráty sú štruktúrované vo forme kryštálovej mriežky. Molekuly vody sú v nej rozmiestnené nepravidelne. Často sa používa termín „kryštalická voda“. Hydráty sa získavajú hydratáciou . Molekuly solí, najmä deriváty anorganických kyselín, s najväčšou pravdepodobnosťou podliehajú tejto reakcii. Hydratácia zahŕňa premenu bezvodých kryštálov na hydratované. Môže spôsobiť zmenu minerálnej hmoty, ale nezničí ju. Hydratácia často sprevádza ďalšie procesy, ako je karbonizácia. Hydratačné chemikálie sa za normálnych podmienok vyznačujú vysokou hygroskopicitou , tj silnou afinitou k molekulám vody. Takéto látky sú schopné napríklad absorbovať vlhkosť zo vzduchu . Ďalším spôsobom, ako získať hydráty, je ich kryštalizácia z vodných roztokov. Molekulové vzorce hydrátov sa tvoria zapísaním vzorca soli a uvedením počtu molekúl hydratovanej vody. S cieľom poskytnúť všeobecnú notáciu je písmeno „n“ umiestnené pred „H 2 O“. Jeho hodnoty sú väčšie ako jedna a zodpovedá počtu pripojených molekúl vody. Najbežnejšie rozdiely sú medzi hydrátmi s n=½ (hemihydrát), n=1 (monohydrát), n=2 (dihydrát) a n=3 (trihydrát). Dôležité je, že tá istá látka môže pripojiť rôzny počet molekúl vody. ![]()
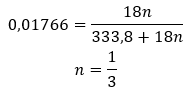 Vzhľadom na to, že medzi molekulami soli a molekulami vody sú vodíkové väzby , tieto zlúčeniny nevykazujú uspokojivú odolnosť voči zvýšeným teplotám. Pri zahrievaní sa rozpadajú a menia sa na bezvodé formy. Hydráty sa veľmi dobre rozpúšťajú vo vode. Vo vodných roztokoch sa uvoľňujú hydratované molekuly vody naviazané na soľ. Túto skutočnosť treba brať do úvahy napríklad pri príprave roztokov týchto látok. Nezohľadnenie stupňa hydratácie danej zlúčeniny má za následok chyby, aj keď len pri stanovení koncentrácie roztoku. Dôležitou charakteristikou hydratovaných solí je zmena ich farby v dôsledku pripojenia molekúl vody v hydratačnej reakcii. Je potrebné poznamenať, že hydratované formy vykazujú výrazne nižšiu hygroskopickosť v porovnaní s bezvodými soľami.
Vzhľadom na to, že medzi molekulami soli a molekulami vody sú vodíkové väzby , tieto zlúčeniny nevykazujú uspokojivú odolnosť voči zvýšeným teplotám. Pri zahrievaní sa rozpadajú a menia sa na bezvodé formy. Hydráty sa veľmi dobre rozpúšťajú vo vode. Vo vodných roztokoch sa uvoľňujú hydratované molekuly vody naviazané na soľ. Túto skutočnosť treba brať do úvahy napríklad pri príprave roztokov týchto látok. Nezohľadnenie stupňa hydratácie danej zlúčeniny má za následok chyby, aj keď len pri stanovení koncentrácie roztoku. Dôležitou charakteristikou hydratovaných solí je zmena ich farby v dôsledku pripojenia molekúl vody v hydratačnej reakcii. Je potrebné poznamenať, že hydratované formy vykazujú výrazne nižšiu hygroskopickosť v porovnaní s bezvodými soľami.
Hydráty anorganických zlúčenín
Soli anorganických kyselín sú látky, ktoré s najväčšou pravdepodobnosťou tvoria hydráty s molekulami vody. Medzi najbežnejšie hydráty anorganických zlúčenín patria:
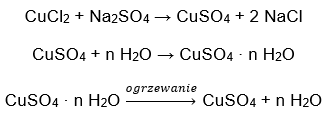
- Hydrát síranu meďnatého (VI), CuSO 4 – síran meďnatý (VI) má rôzne stupne hydratácie. Maximálny počet pripojených molekúl vody je päť. V dôsledku zahrievania pentahydrátu tejto soli dochádza k odstráneniu molekúl vody. Vytvoria sa prvé dva a trihydrát a ďalším zahrievaním systému sa môže získať monohydrát síranu meďnatého (VI). Na odstránenie poslednej molekuly vody je potrebné zahriať zlúčeninu na teplotu vyššiu ako 200 ᵒC. Hydráty síranu meďnatého (VI) majú modrú farbu, čo je spôsobené prítomnosťou kryštalickej vody okolo iónov medi. Zatiaľ čo bezvodá soľ má bielu farbu. Jeho vysoká hygroskopickosť a schopnosť vytvárať hydráty sa využíva na odstránenie vlhkosti z niektorých tekutín.
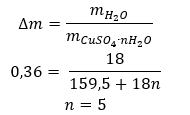
- Hydrát chloridu kobaltnatého, CoCl 2 – bezvodý chlorid kobaltnatý (II) je vysoko hygroskopický. Vďaka svojej silnej afinite k molekulám vody je schopný absorbovať vlhkosť aj zo vzduchu. Tento proces vedie k tvorbe hydrátov tejto soli. Najbežnejšou hydratovanou formou je hexahydrát chloridu kobaltnatého – CoCl 2 * 6H 2 Ďalšou formou je molekula dihydrátu. Táto soľ tiež vykazuje schopnosť meniť farbu v závislosti od obsahu vlhkosti. Bezvodá soľ je modrá, dihydrát nadobúda ružovo-fialovú farbu a farba molekuly hexahydrátu je intenzívne červená.
- Hydrát síranu sodného (VI), Na 2 SO 4 – táto soľ existuje vo forme dvoch hydrátov: heptahydrátu (päť molekúl vody v štruktúre) a dekahydrátu (desať molekúl vody v štruktúre). Bezvodá forma síranu sodného (VI) sa v prírode vyskytuje ako vzácny minerál thénardit. Desaťhydrát síranu sodného (VI) je takzvaná Glauberova soľ. Je široko používaný pri výrobe skla, papiera, pracieho prostriedku a sódy. Glauberova soľ je tiež jednou zo zložiek potrebných na výrobu modrého pigmentu ultramarínu. Okrem toho má zlúčenina terapeutický účinok na tráviaci systém vďaka svojim laxatívnym vlastnostiam.

Sadra
Príkladom hydrátu anorganickej soli globálneho významu a širokého použitia je sadra. Je to minerál tvorený hydratovanou formou síranu vápenatého (VI), CaSO 4 . Kryštalická sadra je dihydrátom tejto soli. V prírodných podmienkach vzniká pri vyparovaní slanej vody z jazier a riek, pri teplotách pod 42ᵒC. Bezvodý síran vápenatý (VI) je anhydrit. Označuje sa aj ako bezvodá sadra. Stavebná sadra je na druhej strane hemihydrát síranu vápenatého (VI). Ktorá forma tejto soli sa získa, závisí od teploty prevládajúcej pri spracovaní materskej sedimentárnej horniny. Sadra používaná v stavebníctve je zvyčajne zmesou rôznych foriem hydratovanej vápennej soli. 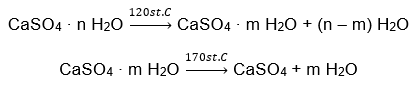
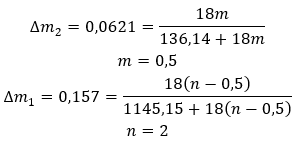 Možnosti použitia sadry sú veľmi široké, najmä v stavebníctve. Najdôležitejšie použitia tohto hydrátu soli sú uvedené nižšie:
Možnosti použitia sadry sú veľmi široké, najmä v stavebníctve. Najdôležitejšie použitia tohto hydrátu soli sú uvedené nižšie:
- V stavebníctve sa sadra používa na dokončovacie prvky. Je jednou zo zložiek sypkých polotovarov, mált, lepidiel, sadrových apretúr a hotových montážnych komponentov, napr. sadrokartónu.
- Medicína používa sadru na vystuženie zlomených končatín. Sadrové obväzy sa považujú za šetrné k pokožke. Okrem toho sa materiál používa aj v laboratóriách zubnej techniky.
- Priemysel používa sadru v modelovacích a dizajnérskych dielňach. Sadrové odliatky sú veľmi vhodné na tvarovanie rôznych úžitkových predmetov.
- Sadra je prísada do niektorých hnojív používaných v poľnohospodárstve.

Metánové klatráty
Metánové klatráty patria do skupiny zlúčenín známych ako plynové hydráty. Sú zodpovedné za väčšinu rýchlych klimatických zmien v histórii Zeme. Metánové klatráty sa tiež často označujú ako hydráty metánu alebo metánový ľad. Tvoria pevnú formu vody a metánu . Ich molekuly sa vyznačujú kryštalickou štruktúrou. Vznikajú pod zvýšeným tlakom. Majú formu bielych pevných látok bez zápachu, ktoré sú často z hľadiska vonkajšieho vzhľadu podobné ľadu. Zaujímavé je, že na dotyk pripomínajú polystyrén . Klatráty sú jedinečné chemické zoskupenia . Molekuly vody tvoria štruktúru, ktorá pripomína klietku. V tejto klietke je uložený metán. Dôležité je, že tieto dve látky medzi sebou nevytvárajú chemické väzby. Metánové klatráty sa zvyčajne skladajú zo 46 molekúl vody obklopujúcich dve malé a šesť stredne veľkých klietok. V nich sú zachytené molekuly metánu. Je tiež známe, že klatráty pozostávajú zo 136 molekúl vody so 16 malými a ôsmimi veľkými klietkami plynného metánu vo vnútri. V posledných rokoch boli na dne oceánov objavené značné množstvá tohto zdroja. Vzbudzuje veľký záujem kvôli potenciálu ťažiť značné množstvá metánu, ktorý možno využiť napríklad na energetické účely. Metánové klatráty horia rovnomerným plameňom, červenkastej farby. Po spálení zostáva roztavená voda. Metán extrahovaný týmto spôsobom môže byť dobrou alternatívou ku konvenčným zdrojom uhľovodíkov , ale predstavuje aj veľkú hrozbu pre klímu. Stále nie sú dostatočné poznatky o využívaní metánu z klatrátov nahromadených na dne oceánov. Nekontrolované uvoľňovanie značného množstva tohto plynu môže byť veľmi nebezpečné, pretože zosilňuje skleníkový efekt oveľa silnejšie ako oxid uhličitý.
