Pri pohľade na ich štruktúru sú karboxylové kyseliny dôležitými organickými zlúčeninami a sú to acylové deriváty. Sú akýmsi stavebným materiálom pre mnohé deriváty, vrátane esterov a amidov. V prírode nájdeme celý rad rôznych karboxylových kyselín, ako je kyselina octová CH 3 COOH, ktorá je základnou zlúčeninou stolového octu, kyselina maslová CH 3 CH 2 CH 2 COOH zodpovedná za vôňu zatuchnutého masla, či viac komplexná kyselina cholová, ktorá je základnou zložkou ľudských žlčových štiav.

Všeobecný vzorec karboxylových kyselín je:
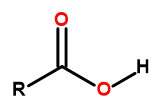
Obrázok 1 Všeobecný vzorec karboxylových kyselín je:
Názvoslovie karboxylových kyselín
Podľa nomenklatúrneho systému IUPAC môžu byť karboxylové kyseliny pomenované dvoma spôsobmi, v závislosti od veľkosti a zložitosti molekuly. Kyseliny, ktoré sú alifatickými derivátmi, sú pomenované systematicky zmenou alkánovej koncovky z -án na -oovú a pridaním počiatočného slova „kyselina“, napríklad kyselina propánová, kyselina butánová, kyselina 3-etyl-6-metyloktándiová. Číslovanie atómov uhlíka v takýchto chemických zlúčeninách vždy začína atómom vo funkčnej skupine –COOH. Druhý systém pomenovávania, obzvlášť užitočný pre kyseliny, v ktorých je karboxylová skupina pripojená ku kruhu, je povolené pridať pred systematický názov zlúčeniny slová „kyselina“ a „karboxylová“ za ňou. V takýchto prípadoch číslovanie atómov uhlíka začína atómom, ku ktorému je pripojená karboxylová skupina, ktorá sa sama považuje za substituent.
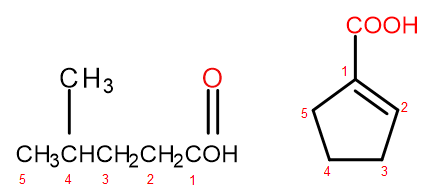
Obrázok 2 Číslovanie atómov uhlíka v, zľava doprava: kyselina 4-metylpentánová, kyselina 1-cyklopentenkarboxylová.
| Kyselina karboxylová | Acylová skupina | ||
| Štruktúra | názov | Štruktúra | názov |
| HCOOH | Formický | HCO- | Formyl- |
| CH3COOH | octová | CH 3 CO- | Acetyl- |
| CH3CH2CH2COOH _ _ | Butyric | CH 3 CH 2 CH 2 CO- | Butyryl- |
| HOOOCCOOH | Oxalic | -OCCO- | Oxalil- |
| HOOC(CH2 ) 2COOH | Succinic | -OC(CH2 ) 2CO- | sukcinyl- |
Štruktúra a fyzikálne vlastnosti karboxylových kyselín
Podobnosť karboxylovej skupiny s ketónmi aj alkoholmi môže naznačovať podobné fyzikálne vlastnosti. Rovnako ako v ketónoch má atóm uhlíka funkčnej skupiny hybridizáciu sp2 . To priamo súvisí s jeho plochou štruktúrou a uhlami asi 120 ° medzi väzbami CCO a OCO. Napríklad kyselina octová CH3COOH má väzbové uhly rovné:
- 119 o pre CC=O,
- 119 o pre CC-OH,
- 122 ° C pre O=C-OH.
Dĺžka väzby je nasledovná:
- 52Å pre CC,
- 25Å pre C=O,
- 31 Á pre C-OH.
Karboxylové kyseliny vykazujú svoju podobnosť s alkoholmi v dôsledku ich silnej asociatívnosti spôsobenej možnosťou tvorby vodíkových väzieb. V praxi väčšina týchto zlúčenín existuje ako cyklické diméry, ktorých štruktúra je udržiavaná tvorbou vodíkových väzieb. Takýto špecifický systém vodíkových väzieb ovplyvňuje aj teploty varu karboxylových kyselín. Spôsobuje ich výrazné zvýšenie v porovnaní s príslušnými alkoholmi. Napríklad fyzikálne konštanty – teplota topenia a teplota varu v stupňoch Celzia sú:
- kyselina mravčia : 8,4; 100,7,
- kyselina octová: 16,6; 117,9,
- kyselina propánová: -20,8; 141,
- kyselina benzoová: 122,1; 249.
Disociácia karboxylových kyselín
Kyslé vlastnosti tejto skupiny zlúčenín im umožňujú reagovať so zásadami, vrátane hydroxidu sodného a hydrogénuhličitanu draselného. Produkty takýchto reakcií sú soli karboxylových kyselín. Rozpustnosť karboxylových kyselín vo vode je zanedbateľná, ale ich soli s alkalickými kovmi sa vďaka svojej iónovej štruktúre vo vode veľmi dobre rozpúšťajú. Tieto zlúčeniny, ktoré sú kyselinami podľa Bronsted-Lowryho teórie, disociujú v zriedených vodných roztokoch. V dôsledku premeny vzniká karboxylátový anión RCOO – a hydróniový katión H 3 O + .
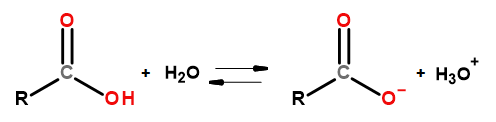
Obrázok 3Schéma disociácie karboxylovej kyseliny.
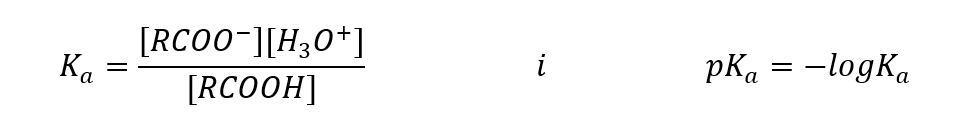 Empiricky stanovené hodnoty pre karboxylové kyseliny ukazujú, že ide o slabo disociované zlúčeniny, takže v praxi ide aj o slabé kyseliny. Pre väčšinu z nich má konštanta K a hodnotu približne 10-5 . Pre kyselinu octovú je Ka = 1,76· 10-5 , čo po konverzii dáva hodnotu pKa rovnú 4,75. To sa rovná disociácii len asi 0,1 %molekúl, čo v porovnaní so silnými anorganickými kyselinami so stupňom disociácie 100 %potvrdzuje, že ide o kyseliny s nízkou pevnosťou. V porovnaní s alkoholmi, ktorých rovnovážne konštanty oscilujú v rádoch 10-16, sú karboxylové kyseliny oveľa silnejšie. Napriek ich štruktúrnej podobnosti je táto skutočnosť spôsobená stabilitou karboxylátového aniónu vzhľadom na alkoxidový anión. Všimnite si, že záporný náboj v alkoxidoch je na jedinom atóme kyslíka, ktorý je vysoko elektronegatívny. Naproti tomu v karboxylátových aniónoch je náboj delokalizovaný medzi dva kyslíky funkčnej skupiny. Vďaka tomu je stabilnejší v porovnaní s aniónom produkovaným alkoholmi.
Empiricky stanovené hodnoty pre karboxylové kyseliny ukazujú, že ide o slabo disociované zlúčeniny, takže v praxi ide aj o slabé kyseliny. Pre väčšinu z nich má konštanta K a hodnotu približne 10-5 . Pre kyselinu octovú je Ka = 1,76· 10-5 , čo po konverzii dáva hodnotu pKa rovnú 4,75. To sa rovná disociácii len asi 0,1 %molekúl, čo v porovnaní so silnými anorganickými kyselinami so stupňom disociácie 100 %potvrdzuje, že ide o kyseliny s nízkou pevnosťou. V porovnaní s alkoholmi, ktorých rovnovážne konštanty oscilujú v rádoch 10-16, sú karboxylové kyseliny oveľa silnejšie. Napriek ich štruktúrnej podobnosti je táto skutočnosť spôsobená stabilitou karboxylátového aniónu vzhľadom na alkoxidový anión. Všimnite si, že záporný náboj v alkoxidoch je na jedinom atóme kyslíka, ktorý je vysoko elektronegatívny. Naproti tomu v karboxylátových aniónoch je náboj delokalizovaný medzi dva kyslíky funkčnej skupiny. Vďaka tomu je stabilnejší v porovnaní s aniónom produkovaným alkoholmi.
Získanie karboxylových kyselín
- Oxidácia substituovaných alkylbenzénov s KMnO 4 alebo Na 2 Cr 2 O 7 s produktom vo forme substituovaných benzoových kyselín. Je možné oxidovať primárne a sekundárne alkylové skupiny,
- Oxidácia väzby C=C v alkénoch s aspoň jedným atómom vodíka vinylu pomocou KMn04 ,
- Oxidácia primárnych alkoholov a aldehydov. Alkoholy používajúce Jonesovo činidlo, aldehydy používajúce rovnaké činidlo a zásaditý oxid strieborný,
- Hydrolýza nitrilov pod vplyvom silných, horúcich roztokov kyselín alebo zásad,
- Reakcia Grignardových zlúčenín s oxidom uhličitým, s medziproduktom vo forme karboxylátu horečnatého. Prechodná zlúčenina potom reaguje s kyselinou.
Reakcie karboxylových kyselín
Karboxylové kyseliny prechádzajú vďaka svojej štruktúre okrem charakteristických reakcií aj premenám podobným alkoholom a ketónom. Podobne ako alkoholy môžu disociovať protón za vzniku nukleofilného činidla. Podobne ako ketóny podliehajú útokom iných nukleofilov na atóm uhlíka karbonylovej skupiny. Okrem toho je možná ich redukcia, substitúcia v polohe alfa, nukleofilná substitúcia acylovej skupiny a deprotonácia (disociácia). Redukcia karboxylových kyselín prebieha pomocou LiAlH4 , čím sa získa produkt ako primárny alkohol. Niekedy je na zvýšenie účinnosti potrebné použiť zahrievanie v roztoku tetrahydrofuránu. Ďalším spôsobom je redukcia pomocou boránu v roztoku tetrahydrofuránu, pričom sa získa tiež 10 alkoholov .
