Je to jedna z dvoch hlavných divízií analytickej chémie, ktorá sa zaoberá detekciou chemických prvkov, funkčných skupín alebo iónov existujúcich v testovanej štruktúre. Z hľadiska použitých metód môžeme chemickú analýzu rozdeliť na klasickú analýzu a inštrumentálnu analýzu. Klasická analýza sa opiera o metódy založené na chemických reakciách, ktoré sa môžu vykonávať v „suchom“ alebo „mokrom“ režime. Naproti tomu inštrumentálna analýza sa spolieha na prístroje, teda analytické meracie prístroje, ktorých hlavným prvkom je detektor.

Klasická analýza: suché reakcie
Pojem „suché reakcie“ sa vzťahuje na zmeny, ku ktorým dochádza v chemických zlúčeninách, keď sú vystavené vysokým teplotám. Rozlišujeme tri hlavné typy takýchto reakcií:
- roztavenie testovanej vzorky pevnými tavidlami,
- získanie guľôčok bóraxu alebo mikrokozmickej soli,
- zafarbenie plameňa plynového horáka.
Najpopulárnejšia je tretia metóda, ktorá sa označuje ako plameňový test a umožňuje detekciu mnohých prvkov. Toto je príklad techniky, ktorá využíva emisiu žiarenia. Spočíva v skúmaní charakteristického žiarenia, ktoré vyžarujú atómy jednotlivých prvkov, keď sú excitované vysokou teplotou. Je to preto, lebo bolo preukázané, že takéto podmienky spôsobujú vyparovanie zlúčenín určitých kovov a vznikajúce pary sú excitované a zafarbujú plameň horáka charakteristickým spôsobom. Farba je efektom excitácie konkrétnych atómov, ktoré pri obnovení do pôvodného stavu vyžarujú svetelné kvantum, ktoré sa vzťahuje na špecifikovanú vlnovú dĺžku. Napríklad farby plameňa charakteristické pre konkrétne prvky sú nasledovné:
- sodík: intenzívna žltá,
- draslík: fialová,
- vápnik: tehlovočervený,
- bárium: zelená,
- bizmut: svetlomodrá.
Klasická analýza: mokré reakcie
Sú to všetky typy reakcií, ktoré sa vyskytujú medzi testovanými vzorkami a roztokmi rôznych chemických činidiel . Na uskutočnenie takýchto reakcií sa musí testovaná látka premeniť na roztok. Aplikované reakcie sa vyberajú na základe mnohých kritérií tak, aby:
- vykazujú vysokú citlivosť, tj vyskytujú sa už pri nízkych koncentráciách detegovanej látky;
- vyskytujú sa v krátkom čase a vykazujú ľahko pozorovateľné zmeny, ako je zmena farby roztoku, zrážky alebo emisie plynu;
- sú selektívne, tj vyskytujú sa len v rámci známej skupiny iónov.

Kvalitatívna analýza: anorganická chémia
V anorganickej chémii sa kvalitatívna analýza točí okolo dvoch tém: detekcia katiónov a aniónov. Anorganická chémia využíva charakteristické reakcie, ktoré zahŕňajú vhodné skupinové činidlá. Nazývajú sa „skupinové činidlá“, pretože katióny boli rozdelené do piatich kategórií. Takéto činidlo tvorí sedimenty iba s jedným z nich, čo umožňuje zúžiť typy katiónov prítomných vo vzorke podľa nasledujúceho vzoru:
- Skupina 1: Ag + , Hg 2 2+ , Pb 2+ – skupinové činidlo 3M HCl;
- Skupina 2: Hg 2+ , Cu 2+ , Cd 2+ , Bi 3+ , As 3+ , As 5+ , Sb 3+ , Sb 5+ , Sn 2+ , Sn 4+ – skupinové činidlo H 2 S v an prostredie 1M HCl;
- Skupina 3: Ni 2+ , Co 2+ , Fe 2+ , Fe 3+ , Mn 2+ , Zn 2+ , Al 3+ , Cr 3+ – skupinové činidlo (NH 4 ) 2 S v prostredí amónneho pufra;
- Skupina 4: Ca 2+ , Sr 2+ , Ba 2+ – skupinové činidlo (NH 4 ) 2 CO 3 v prostredí amónneho pufra;
- Skupina 5: Mg2 + , Na + , K + , NH4 + – žiadne skupinové činidlo.
Keď vylúčime určité skupiny katiónov, môžeme pokračovať v identifikácii s použitím ďalších činidiel, tentoraz takých, ktoré sú charakteristické pre konkrétne ióny. Takáto reakcia umožňuje jednoznačnú identifikáciu. Napríklad detekcia iónov Ag + vo vzorke prebieha v dvoch fázach:
- Reakcia so skupinovým činidlom: tvorba bieleho sedimentu
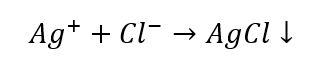
- Charakteristická reakcia: rozpustenie sedimentu AgCl vo vodnom roztoku amoniaku, získanie bezfarebnej komplexnej zlúčeniny.
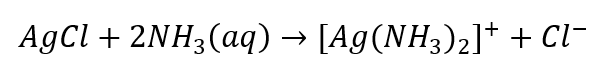
Podobným spôsobom môžeme identifikovať anióny, ktoré sa delia do troch skupín:
- Skupina 1 : BO2- , CO32- , C2042- , Si032- , P043- , As033- , As043- , SO32- , S2032- , SO 4 2- , F – , CrO 4 2- , Cr 2 O 7 2- – skupinové činidlo BaCl 2 , tvorba solí ťažko rozpustných vo vode;
- Skupina 2: C 4 H 4 O 6 2- , S 2- , Cl – , ClO – , Br – , I – , CN – , SCN – – skupinové činidlo AgNO 3 , tvorba solí ťažko rozpustných vo vode a v zried. kyselina dusičná;
- Skupina 3: CH 3 COO – , NO 2 – , NO 3 2- , ClO 3 – , ClO 4 – , MnO 4 – – skupinové činidlo obsahuje katióny striebra alebo bária; tvorba vo vode rozpustných solí.
Identifikácia katiónov je v porovnaní s aniónmi o niečo problematickejšia, pretože postupnosť postupov závisí od výsledkov skupinových reakcií a navyše existujú ióny, ktoré narúšajú proces identifikácie. Napríklad na detekciu iónu CO 3 2- musíme vykonať nasledujúce reakcie:
- Ióny Ba 2+ vytvárajú biely sediment, ktorý je rozpustný v kyselinách
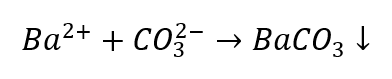
- Zriedené kyseliny spôsobujú rozklad so zrážaním CO 2
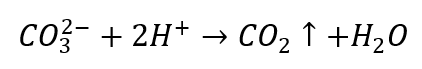
- Oxid uhličitý spôsobuje bublinky roztoku. Môže sa zaliať vápennou vodou, pretože biely sediment sa vyzráža.
* Rušivé ióny: SO 3 2- a S 2 O 3 2- tvoria s katiónom vápnika aj biele usadeniny. Na odstránenie poruchy musia byť oxidované. 
Kvalitatívna analýza: organická chémia
Kvalitatívna analýza organických zlúčenín zahŕňa viacero etáp a kľúčovým bodom je vyriešiť päť základných problémov:
- Stanovenie fyzikálnych parametrov , ako je teplota topenia alebo bodu varu. Bohužiaľ existuje veľa chemických zlúčenín s rovnakými teplotnými bodmi a samotné meranie môže byť ovplyvnené chybou. Ak však máme vhodný referenčný štandard, táto metóda nám môže umožniť rýchlu identifikáciu zlúčeniny. Okrem toho meraním teplôt môžeme určiť čistotu zlúčeniny, pretože teplotné rozsahy sú úzke. Stálosť T top po aspoň jednej kryštalizácii môže tiež naznačovať vysokú čistotu zlúčeniny. Pre kvapaliny môže znamenať úzky destilačný rozsah.
- Stanovenie elementárneho zloženia môže vylúčiť alebo potvrdiť prítomnosť konkrétnych typov organických zlúčenín. Aby sme uviedli príklad, vylúčením prítomnosti atómov dusíka v štruktúre tiež vylúčime prítomnosť aminoskupín alebo dusičných skupín. Na tento účel vykonávame charakteristické experimenty, ako je Lassaignov test na dusík, Beilsteinov test na halogény alebo sírový test s nitroprusidom sodným.
- Testovanie rozpustnosti zlúčeniny nám umožňuje zaradiť ju do skupiny zlúčenín so špecifikovanými chemickými vlastnosťami. Podľa princípu „podobné rozpúšťa podobné“ sú zlúčeniny rozdelené do 7 kategórií.
- Identifikácia funkčných skupín vyžaduje vhodné analytické reakcie, ktoré umožňujú vylúčiť alebo identifikovať funkčné skupiny.
- Spektrálna analýza je najspoľahlivejším bodom, ktorý nám umožňuje jasne identifikovať chemickú zlúčeninu. Zahŕňa všetky inštrumentálne techniky, ako napríklad:
- Hmotnostná spektrometria (MS) , ktorá spočíva v ionizácii molekúl a detekcii počtu iónov stanovením ich pomeru hmotnosti k náboju. To nám umožňuje vyvodiť závery o hmotnosti analyzovanej zlúčeniny;
- Nukleárna magnetická rezonančná (NMR) spektroskopia , ktorá poskytuje špecifické informácie o štruktúre. Poskytuje obraz magnetických jadier ( 13 C, 1 H), čo umožňuje dôkladnú interpretáciu ich kvality;
- Infračervená (IR) spektroskopia využíva úzky rozsah elektromagnetického žiarenia na zobrazenie typov vibrácií existujúcich v testovanej molekule.
























































































































