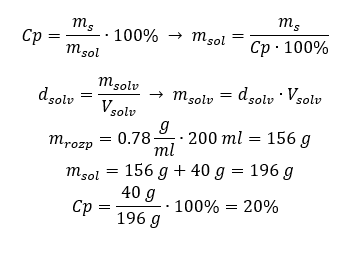V chémii často používame pojmy ako „koncentrovaný roztok“, „zriedený roztok“ alebo „nasýtený roztok“, ale dajú nám len základný prehľad o tom, či roztok obsahuje veľké alebo malé množstvo konkrétnej látky. Existuje však niekoľko metód, ktoré nám pomáhajú presne určiť kvantitatívne zloženie daného roztoku. Jeden z nich je popísaný v nasledujúcom článku.

Definícia percentuálnej koncentrácie
Pojem „koncentrácia“ sa vzťahuje na mieru množstva danej látky obsiahnutej v konkrétnom roztoku . Koncentrácia môže byť vyjadrená v jednotkách na základe mier, ktoré používame, napríklad v móloch, gramoch alebo v percentách. Percentuálna koncentrácia udáva, koľko hmotnostných dielov rozpustenej látky je zahrnutých v 100 hmotnostných dieloch roztoku. Inými slovami, je to počet gramov rozpustenej látky v 100 g roztoku. Ak kupujeme napríklad mlieko s označením 3,2 %, znamená to, že 100 g mlieka obsahuje 3,2 g tuku. Percentuálna koncentrácia sa označuje skratkou Cp.
Všeobecný vzorec percentuálnej koncentrácie
Na odvodenie vzorca pre percentuálnu koncentráciu je potrebné pamätať na to, že hmotnosť roztoku (m sol ) obsahuje nielen hmotnosť rozpúšťadla (m solv ), ale aj hmotnosť rozpustenej látky ( m s ) : m sol = m solv + m s Napríklad, ak vezmeme 4%roztok s hmotnosťou 100 g, vieme, že Cp = 4%, takže hmotnosť látky je 4 g. Definícia percentuálnej koncentrácie udáva, že ak je hmotnosť roztoku 100 g, potom hmotnosť rozpúšťadla je 96 g. Percentuálnu koncentráciu možno vypočítať podľa nasledujúceho vzorca: Cp = (m s /m sol ) · 100 %Ako vidíme zo vzorca, ak poznáme hmotnosť roztoku a hmotnosť látky, môžeme ľahko vypočítať percentuálna koncentrácia. Napríklad, ak vieme, že roztok váži 450 g a rozpustená látka váži 15 g, potom vložením týchto čísel do vzorca získame nasledovné: Cp = (15/450) · 100 %= 3,3 %
Výpočet hmotnosti jednotlivých zložiek v roztoku
Každý vzorec, vrátane vzorca pre percentuálnu koncentráciu, je možné preusporiadať. Ak poznáme hmotnosť a percentuálnu koncentráciu roztoku, môžeme vypočítať hmotnosť rozpustenej látky. Podobne, ak poznáme percentuálnu koncentráciu a hmotnosť látky, môžeme vypočítať hmotnosť roztoku. Okrem preskupenia vzorca môžeme použiť aj vhodné proporcie. Príklad 1. Koľko gramov cukru potrebujeme na prípravu 300 g 10 %roztoku? Z návodu vieme, že hmotnosť roztoku je 300 g a jeho percentuálna koncentrácia je 10 %. Hmotnosť rozpustenej látky možno určiť dvoma spôsobmi. Metóda 1. Preusporiadanie vzorca 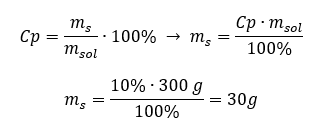 Metóda 2. Použitím pomerov s vedomím, že 10 %roztok obsahuje 10 g cukru v 100 g roztoku:
Metóda 2. Použitím pomerov s vedomím, že 10 %roztok obsahuje 10 g cukru v 100 g roztoku: 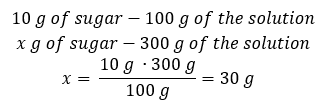 Obe metódy nás privedú k záveru, že na prípravu 300 g 10%roztoku bude potrebných 30 g cukru.
Obe metódy nás privedú k záveru, že na prípravu 300 g 10%roztoku bude potrebných 30 g cukru.  Príklad 2. V koľkých gramoch vody musíme rozpustiť 10 g látky, aby sme získali 50 %roztok? Z návodu vieme, že hmotnosť látky je 10 g a percentuálna koncentrácia roztoku je 50 %. To znamená, že 100 g roztoku obsahuje 50 g látky. Hmotnosť roztoku možno určiť dvoma spôsobmi. Upozorňujeme, že hmotnosť roztoku sa nerovná hmotnosti rozpúšťadla. Na výpočet hmotnosti rozpúšťadla musíme od hmotnosti roztoku odpočítať hmotnosť látky. Metóda 1. Preusporiadanie vzorca
Príklad 2. V koľkých gramoch vody musíme rozpustiť 10 g látky, aby sme získali 50 %roztok? Z návodu vieme, že hmotnosť látky je 10 g a percentuálna koncentrácia roztoku je 50 %. To znamená, že 100 g roztoku obsahuje 50 g látky. Hmotnosť roztoku možno určiť dvoma spôsobmi. Upozorňujeme, že hmotnosť roztoku sa nerovná hmotnosti rozpúšťadla. Na výpočet hmotnosti rozpúšťadla musíme od hmotnosti roztoku odpočítať hmotnosť látky. Metóda 1. Preusporiadanie vzorca 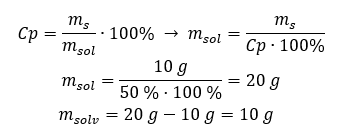 Metóda 2. Použitím pomerov s vedomím, že 100 g roztoku obsahuje 50 g látky.
Metóda 2. Použitím pomerov s vedomím, že 100 g roztoku obsahuje 50 g látky. 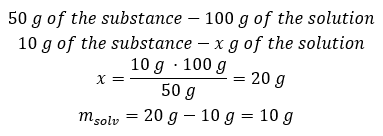 Bez ohľadu na metódu, ktorú použijeme, odpoveď bude taká, že na získanie 50%roztoku musíme rozpustiť 10 g látky v 10 g vody.
Bez ohľadu na metódu, ktorú použijeme, odpoveď bude taká, že na získanie 50%roztoku musíme rozpustiť 10 g látky v 10 g vody.
Príprava riešení
Kľúčovým prvkom práce v laboratóriu je znalosť prípravy roztokov s konkrétnymi koncentráciami. Na tento účel musíme poznať hmotnosť jeho zložiek. Predtým vypočítaná hmotnosť látky by sa mala rozpustiť v presne odmeranom objeme rozpúšťadla. Potrebný objem možno vypočítať, ak poznáme hmotnosť a hustotu kvapaliny. Hustota roztoku je fyzikálna hodnota špecifická pre každú kvapalinu, ktorá definuje hmotnosť roztoku na jednotku objemu. Táto hodnota úzko súvisí s teplotou. Ak vieme, že hustota roztoku je 2,03 g/ml, tak vieme aj to, že 1 ml roztoku váži 2,03 g. Zvyčajne používame tieto jednotky hustoty: g/ml = g/cm 3 , g/l = g/dm 3 , ale existujú aj iné, napríklad kg/m 3 . Hustota roztoku sa vypočíta podľa nasledujúceho vzorca: d sol = m sol /v sol , kde m sol je hmotnosť roztoku a V sol je jeho hustota. Ak poznáme objem a hustotu roztoku, vieme vypočítať jeho hmotnosť. Príklad 3. Akú hmotnosť má 20 ml roztoku s hustotou 1,201 g/ml? Metóda 1. Preusporiadanie vzorca 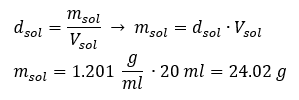 Metóda 2. Použitím pomerov s vedomím, že 1,201 g roztoku má objem 1 ml
Metóda 2. Použitím pomerov s vedomím, že 1,201 g roztoku má objem 1 ml 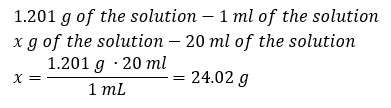 Obe metódy ukázali, že roztok s hustotou 1,201 g/ml a objemom 20 ml má hmotnosť 24,02 g. Ak poznáme hustotu, môžeme vykonať ešte viac výpočtov v kontexte percentuálnej koncentrácie. Príklad 4. Koľko gramov soli obsahuje 10 ml 15 %roztoku, ak jeho hustota je 1,035 g/ml? Metóda 1. Preusporiadanie vzorcov
Obe metódy ukázali, že roztok s hustotou 1,201 g/ml a objemom 20 ml má hmotnosť 24,02 g. Ak poznáme hustotu, môžeme vykonať ešte viac výpočtov v kontexte percentuálnej koncentrácie. Príklad 4. Koľko gramov soli obsahuje 10 ml 15 %roztoku, ak jeho hustota je 1,035 g/ml? Metóda 1. Preusporiadanie vzorcov 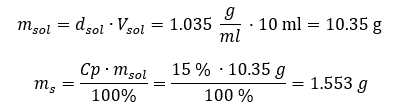 Metóda 2. Použitie proporcií
Metóda 2. Použitie proporcií 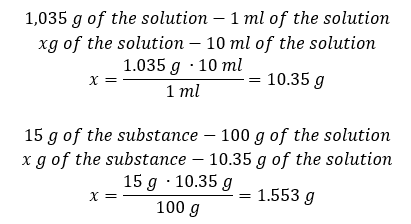 Obe metódy ukázali, že na prípravu 10 ml roztoku s Cp = 15 %a hustotou 1,035 g/ml musíme navážiť 1,553 g soli. Príklad 5. Aká je percentuálna koncentrácia roztoku, ktorý vznikne rozpustením 40 g látky v 200 ml etanolu s hustotou 0,78 g/ml? Na výpočet môžeme použiť vzorec pre percentuálnu koncentráciu. Hmotnosť roztoku sa môže vypočítať sčítaním hmotností rozpustenej látky a rozpúšťadla. Hmotnosť rozpúšťadla nie je známa, ale poznáme jeho hustotu a objem, takže chýbajúce údaje možno vypočítať preskupením vzorca pre hustotu.
Obe metódy ukázali, že na prípravu 10 ml roztoku s Cp = 15 %a hustotou 1,035 g/ml musíme navážiť 1,553 g soli. Príklad 5. Aká je percentuálna koncentrácia roztoku, ktorý vznikne rozpustením 40 g látky v 200 ml etanolu s hustotou 0,78 g/ml? Na výpočet môžeme použiť vzorec pre percentuálnu koncentráciu. Hmotnosť roztoku sa môže vypočítať sčítaním hmotností rozpustenej látky a rozpúšťadla. Hmotnosť rozpúšťadla nie je známa, ale poznáme jeho hustotu a objem, takže chýbajúce údaje možno vypočítať preskupením vzorca pre hustotu.