Výraz „pH pufry“ označuje také vodné roztoky, ktoré nemenia svoju hodnotu pH napriek zavedeniu malého množstva zásad alebo kyselín alebo počas riedenia. V praxi sú to zmesi roztokov slabých kyselín a ich solí s koncentrovanými silnými zásadami (donor protónov – akceptor protónov) alebo obdobne zmesi roztokov slabých zásad a ich solí so silnými kyselinami. Hlavným cieľom použitia tlmivých roztokov je, že pôsobia ako činidlá, ktoré umožňujú udržiavať hodnotu pH na pomerne stabilnej úrovni. Často sa používajú v širokej škále chemických aplikácií, napríklad pri výrobe farbív, počas fermentačných procesov, ako aj na stanovenie hodnoty pH potravinárskych výrobkov, kozmetiky a liečiv.
Henderson-Hasselbachova rovnica
Hlavná závislosť hodnoty pH tlmivého roztoku od pKa alebo pKb použitých pre kyselinu alebo zásadu, ako aj pomer koncentrácií kyseliny a jej konjugovanej zásady alebo analogicky zásady a jej konjugovanej kyseliny je definovaná Hendersonovou-Hasselbachovou rovnicou. Ukazuje koreláciu medzi silou aplikovanej kyseliny a hodnotou pH. Pre reakciu vzorky tlmivého roztoku vyrobeného s použitím slabej kyseliny je postup nasledovný: HA + H 2 O ↔ H 3 O + + A – Zatiaľ čo korelácia medzi [A –], to je molárna koncentrácia konjugovanej bázy [mol ·dm -3], [HA], čo je molárna koncentrácia nedisociovanej kyseliny a pKa – záporný logaritmus rovnovážnej disociačnej konštanty kyseliny (Ka) , vyjadrené Hendersonovou-Hasselbachovou rovnicou pre takúto reakciu, má nasledujúci tvar: 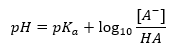
Henderson-Hasselbachova rovnica pre acetátový pufor
Funkčný mechanizmus pufrov je založený na prítomnosti iónov, ktoré sú schopné viazať vodíkové alebo hydroxidové ióny. Keď uvažujeme o acetátovom pufri, ktorý je zmesou kyseliny octovej a octanu sodného, mali by sme si všimnúť disociačnú reakciu medzi slabou kyselinou octovou a silným elektrolytom, octanom sodným (CH 3 COONa), ktorý je úplne disociovaný na ióny: CH 3 COOH ↔ H + + CH 3 COO – CH 3 COONa → CH 3 COO – + Na + Keďže tlmivý roztok je zmesou týchto iónov, pridaním malého množstva silnej kyseliny sa zavádza [H + } } ióny, ktoré sú bezprostredne viazané aniónmi CH3COO – za vzniku kyseliny octovej, ktorá je za týchto podmienok nedisociovaná. V dôsledku toho sa znižuje hodnota pH. Rovnakým spôsobom prísun ďalších OH – katiónov zavedením silnej zásady do roztoku nezvýši hladinu pH. Budú okamžite viazané iónmi H + vznikajúcimi pri disociácii kyseliny octovej na nedisociované molekuly vody. Rovnica definujúca kyslú disociačnú konštantu je uvedená nižšie: 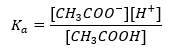 Pre disociáciu slabej kyseliny octovej je celková koncentrácia aniónu CH 3 COO – definovaná koncentráciou iónov pochádzajúcich z disociácie soli, ktorá je zasa rovnaká ako koncentrácia soli (c s ), to je octan sodný. Vysoká koncentrácia týchto aniónov spôsobuje pokles koncentrácie katiónov H + a následne sa znižuje stupeň disociácie kyseliny, aby sa udržala stabilná hodnota Ka. Vzhľadom na tento vzťah môžeme tiež predpokladať, že počet nedisociovaných molekúl CH 3 COOH je prakticky identický s celkovou koncentráciou kyseliny octovej ( ck ). Preto možno disociačnú konštantu zaznamenať takto:
Pre disociáciu slabej kyseliny octovej je celková koncentrácia aniónu CH 3 COO – definovaná koncentráciou iónov pochádzajúcich z disociácie soli, ktorá je zasa rovnaká ako koncentrácia soli (c s ), to je octan sodný. Vysoká koncentrácia týchto aniónov spôsobuje pokles koncentrácie katiónov H + a následne sa znižuje stupeň disociácie kyseliny, aby sa udržala stabilná hodnota Ka. Vzhľadom na tento vzťah môžeme tiež predpokladať, že počet nedisociovaných molekúl CH 3 COOH je prakticky identický s celkovou koncentráciou kyseliny octovej ( ck ). Preto možno disociačnú konštantu zaznamenať takto: 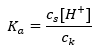 Po logaritmovaní získame vzťah, ktorý vedie k Henderson-Hasselbachovej rovnici:
Po logaritmovaní získame vzťah, ktorý vedie k Henderson-Hasselbachovej rovnici: 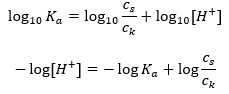 Henderson-Hasselbachova rovnica má teda nasledujúci tvar:
Henderson-Hasselbachova rovnica má teda nasledujúci tvar: 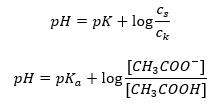 Aby sme napísali vzťahy, hodnota pKa v rovnici je v skutočnosti mierou sily kyseliny. Akékoľvek hodnoty pKa nižšie ako 3 (-log(0,001)) sú charakteristické pre silné kyseliny, pričom čím je hodnota vyššia, tým je kyselina slabšia. Faktom vyplývajúcim z Henderson-Hasselbachovej rovnice je ekvivalencia hodnoty pH tlmivého roztoku a pKa kyseliny v momente, keď pomer koncentrácie nedisociovanej kyseliny a koncentrácie aniónu vzniknutého disociáciou kyseliny sa rovná 1, pretože log(1) sa rovná 0. Takéto podmienky existujú ako výsledok titrácie slabej kyseliny silnou zásadou, ak pridáme také množstvo zásady, ktoré zodpovedá polovici množstva potrebného na úplnú neutralizáciu kyseliny. Potom je stupeň titrácie roztoku 50 %. V závislosti medzi pH a objemom použitého titračného činidla sa hodnota pH v oblasti pufra mení pomerne pomaly.
Aby sme napísali vzťahy, hodnota pKa v rovnici je v skutočnosti mierou sily kyseliny. Akékoľvek hodnoty pKa nižšie ako 3 (-log(0,001)) sú charakteristické pre silné kyseliny, pričom čím je hodnota vyššia, tým je kyselina slabšia. Faktom vyplývajúcim z Henderson-Hasselbachovej rovnice je ekvivalencia hodnoty pH tlmivého roztoku a pKa kyseliny v momente, keď pomer koncentrácie nedisociovanej kyseliny a koncentrácie aniónu vzniknutého disociáciou kyseliny sa rovná 1, pretože log(1) sa rovná 0. Takéto podmienky existujú ako výsledok titrácie slabej kyseliny silnou zásadou, ak pridáme také množstvo zásady, ktoré zodpovedá polovici množstva potrebného na úplnú neutralizáciu kyseliny. Potom je stupeň titrácie roztoku 50 %. V závislosti medzi pH a objemom použitého titračného činidla sa hodnota pH v oblasti pufra mení pomerne pomaly. 
Príklad: amónny pufor
Ďalším typom pufra je amónny pufor, ktorý je zmesou slabej zásady (NH 4 OH) so silnou kyselinou (NH 4 Cl). Mechanizmus je však veľmi podobný. Soľ prítomná v zmesi podlieha úplnej disociácii a jej konštanta je nasledujúca rovnica: 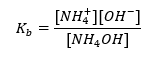 Zatiaľ čo amónna zásada je v silnom elektrolyte ( NH4Cl ) prakticky nedisociovaná. Z tohto dôvodu predpokladáme, že koncentrácia katiónu NH 4 + sa rovná koncentrácii soli, ale koncentrácia nedisociovaných molekúl NH 4 OH je totožná s koncentráciou zásady. To umožňuje formulovať rovnicu a vypočítať pH tohto pufra.
Zatiaľ čo amónna zásada je v silnom elektrolyte ( NH4Cl ) prakticky nedisociovaná. Z tohto dôvodu predpokladáme, že koncentrácia katiónu NH 4 + sa rovná koncentrácii soli, ale koncentrácia nedisociovaných molekúl NH 4 OH je totožná s koncentráciou zásady. To umožňuje formulovať rovnicu a vypočítať pH tohto pufra. 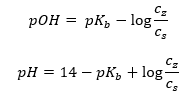 Ióny NH 4 + a Cl – a molekuly NH 4 OH prítomné v amónnom tlmivom roztoku vedú k tomu, že po pridaní kyseliny alebo zásady nastanú tieto reakcie: NH 4 OH + H + ↔ NH 4 + + H 2 O NH 4 + + OH – ↔ NH 4 OH Ak je prídavok malý, je malá aj zmena pomeru koncentrácie zásady a soli, a tým aj zmena pH. V prípade desaťnásobnej zmeny pomeru týchto koncentrácií sa hodnota pH zmení o jednotku.
Ióny NH 4 + a Cl – a molekuly NH 4 OH prítomné v amónnom tlmivom roztoku vedú k tomu, že po pridaní kyseliny alebo zásady nastanú tieto reakcie: NH 4 OH + H + ↔ NH 4 + + H 2 O NH 4 + + OH – ↔ NH 4 OH Ak je prídavok malý, je malá aj zmena pomeru koncentrácie zásady a soli, a tým aj zmena pH. V prípade desaťnásobnej zmeny pomeru týchto koncentrácií sa hodnota pH zmení o jednotku.
Kapacita vyrovnávacej pamäte
Pojem „tlmivá kapacita“ sa vzťahuje na kapacitu tlmivého roztoku udržiavať približne konštantnú kyslosť roztoku. Presnejšie ide o počet gramekvivalentov silnej kyseliny alebo silnej zásady, ktorá po pridaní do 1 dm 3 tlmivého roztoku zmení hodnotu pH o jednu. Vzorec definujúci tlmivú kapacitu (β) zahŕňa jej závislosť od počtu mólov silnej kyseliny/zásady po pridaní do tlmivého roztoku (Δn, [ml]) a zmeny pH pozorovanej počas pridávania objem silnej kyseliny alebo zásady do tlmivého roztoku (ΔpH). ![]() Je to hodnota, ktorá silne súvisí s koncentráciami zložiek, ktoré sa zvyšujú, keď sa zvyšujú. Najvyššia hodnota pufrovacej kapacity charakterizuje pufrovacie roztoky, ktorých pH sa rovná disociačnej konštante (pKa) kyseliny použitej na ich výrobu.
Je to hodnota, ktorá silne súvisí s koncentráciami zložiek, ktoré sa zvyšujú, keď sa zvyšujú. Najvyššia hodnota pufrovacej kapacity charakterizuje pufrovacie roztoky, ktorých pH sa rovná disociačnej konštante (pKa) kyseliny použitej na ich výrobu.
Princíp činnosti fosfátového pufra
Menej obľúbeným typom pufrov sú také pufre, ktoré obsahujú dve kyslé soli. V tomto prípade sú to dve kyslé soli kyseliny ortofosforečnej (V), to je dihydrogenfosforečnan sodný (V) a hydrogenfosforečnan sodný (V). Na rozdiel od najbežnejších pufrov, ktoré sú tiež založené na Brønstedovom princípe konjugovaných acidobázických párov, nie je také ľahké určiť povahu zložiek. Keďže anióny prítomné vo fosfátovom pufri vykazujú hodnoty charakteristické pre Brønstedove kyseliny, mali by sme pozornejšie kontrolovať rozdiel medzi nimi. Podľa tohto princípu musí mať ión, ktorý je silnejšou kyselinou, vyššiu disociačnú konštantu.
- Pre H2P04 – Ka = 6,34-10-8
- Pre HPO4-2 Ka = 4,36 · 10-13
Ak máme takéto údaje k dispozícii, môžeme ľahko konštatovať, že v tomto prípade je to vodíkový anión H2PO4-13 , ktorý je slabou Brønstedovou kyselinou. Prevádzkový mechanizmus vyrovnávacej pamäte je založený na dynamickej rovnováhe, ktorú možno vyjadriť nasledujúcou rovnicou: ![]() Ak do tlmivého roztoku pridáme malé množstvá kyseliny, systém sa pokúsi zabrániť zmenám pH v dôsledku reakcie blokovania účinku katiónov [H +] protonizáciou aniónu vodíka, podľa nasledujúceho rovnica:
Ak do tlmivého roztoku pridáme malé množstvá kyseliny, systém sa pokúsi zabrániť zmenám pH v dôsledku reakcie blokovania účinku katiónov [H +] protonizáciou aniónu vodíka, podľa nasledujúceho rovnica: ![]() Skutočnosť, že je to anión, ktorý neutralizuje tlmivé roztoky pridané do roztoku, je dôsledkom skutočnosti, že práve tento anión je silnejšou Brønstedovou bázou. V takýchto systémoch aplikujeme pravidlo, že čím silnejšia je Brønstedova kyselina, tým slabšia je jej konjugovaná báza. Ak do systému obsahujúceho niekoľko Brønstedových zásad pridáme kyselinu, potom ako prvá zareaguje najsilnejšia zásada. Tento vzťah je najdôležitejšou zložkou pri analýze rovnováh existujúcich v zmesiach vodných tlmivých roztokov pozostávajúcich zo zmesi Brønstedových kyselín a zmesi slabých Brønstedových zásad. Rovnaké pravidlo, ale v opačnom poradí, platí, keď pridávame zásaditý roztok do fosfátového pufra. OH- anióny budú takmer okamžite zachytené silnejšou Brønstedovou kyselinou prítomnou v pufri. V tomto prípade to bude ión a reakcia bude prebiehať podľa nasledujúcej rovnice:
Skutočnosť, že je to anión, ktorý neutralizuje tlmivé roztoky pridané do roztoku, je dôsledkom skutočnosti, že práve tento anión je silnejšou Brønstedovou bázou. V takýchto systémoch aplikujeme pravidlo, že čím silnejšia je Brønstedova kyselina, tým slabšia je jej konjugovaná báza. Ak do systému obsahujúceho niekoľko Brønstedových zásad pridáme kyselinu, potom ako prvá zareaguje najsilnejšia zásada. Tento vzťah je najdôležitejšou zložkou pri analýze rovnováh existujúcich v zmesiach vodných tlmivých roztokov pozostávajúcich zo zmesi Brønstedových kyselín a zmesi slabých Brønstedových zásad. Rovnaké pravidlo, ale v opačnom poradí, platí, keď pridávame zásaditý roztok do fosfátového pufra. OH- anióny budú takmer okamžite zachytené silnejšou Brønstedovou kyselinou prítomnou v pufri. V tomto prípade to bude ión a reakcia bude prebiehať podľa nasledujúcej rovnice: ![]()
Známe vyrovnávacie pamäte a ich aplikácie
- Krv si udržiava hodnoty 7,35 a 7,45 jednotiek a jej stabilitu zaručuje prítomnosť kyseliny uhličitej, hlavne vo forme rozpusteného oxidu uhličitého a HCO 3- Ide o tlmivý roztok, ktorý je slabou kyselinou a jej soľou a akýmkoľvek prídavkom nadmerné množstvo kyselín alebo zásad spôsobí stavy nebezpečné pre ľudský život. Podobným príkladom pufra sú sliny, ktorých pH je okolo 7.
- Amónne, acetátové, fosfátové a borátové pufre, teda v tomto poradí:
- NH3 + NH4Cl pH = 8 – 11;
- CH 3 COOH + CH 3 COONa pH 3,5 – 6;
- K 2 HPO 4 + KH 2 PO 4 pH = 5,5 – 8;
- H 3 BO 3 + Na 2 B 4 O 7 pH = 7 – 9.
Všetky populárne pufre sa používajú tam, kde je dôležité udržiavať pH na konštantnej úrovni, napríklad:
- v medicíne, kde sa podávajú intravenózne pacientom v kritickom stave;
- v mikrobiálnych kultúrach, kde je dôležitým faktorom reakcia pôdy;
- pri práci s enzýmami a proteínmi stabilizovať prostredie pre chemické reakcie;
- v galvanickom pokovovaní, kde sa používajú na elektrolytické kúpele, pretože umožňujú zabrániť rýchlym, kritickým zmenám ich pH v oblasti blízko elektródy;
- na kalibráciu pH metrov.
