Spektroskopické metódy sú skupinou metód, pri ktorých sa signál vytvára interakciou elektromagnetického alebo korpuskulárneho žiarenia so skúmanou vzorkou. Toto žiarenie môže vzniknúť v dôsledku periodických zmien v elektromagnetickom poli spojených s prenosom energie. Tieto metódy sa používajú na stanovenie koncentrácie alebo obsahu atómov v danom absorbujúcom alebo emitujúcom systéme. Aké typy spektrofotometrie existujú a čo tieto metódy zahŕňajú? To sa dozviete z nášho článku.

Prechody žiarenia a energie
Najdôležitejšou vlastnosťou fotónov alebo kvánt žiarenia je energia. Vzorec pre energetickú hodnotu (E) je súčinom Planckovej konštanty (h) 6,626· 10-34 [J ·s] a frekvencie žiarenia (v) vyjadrenej v Hertzoch [Hz]. 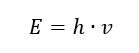 Spektrofotometria využíva energetické prechody v molekulách spôsobené absorpciou alebo emisiou elektromagnetického žiarenia v rôznych rozsahoch:
Spektrofotometria využíva energetické prechody v molekulách spôsobené absorpciou alebo emisiou elektromagnetického žiarenia v rôznych rozsahoch:
- ultrafialové (UV) 200-380 nm,
- viditeľné žiarenie (Vis) 380-780 nm,
- blízke infračervené (IR) 0,78-30000 μm.
Základné pojmy a zákony spektrofotometrie
Izosbestický bod
Toto je bod zodpovedajúci špecifickej vlnovej dĺžke vyplývajúcej z priesečníka kriviek vynesených v systéme absorbancia-vlnová dĺžka, kde obe formy zlúčeniny v roztoku (disociovaná a nedisociovaná) majú rovnakú absorpciu. Zmena pH nemení polohu, zlúčenina môže mať veľa takýchto bodov.
Absorpčné spektrum chemickej zlúčeniny
Spektrum je mierou množstva svetla absorbovaného zlúčeninou z vlnovej dĺžky svetla (λ). Ak na vzorku dopadne elektromagnetické žiarenie (svetlo) o intenzite I 0 , časť tohto žiarenia sa pohltí a časť prejde vzorkou. Zaznamenaním intenzít dopadajúceho (I 0 ) a prepusteného (I t ) žiarenia môžeme určiť množstvo svetla, ktoré je absorbované roztokom (absorbancia, A), alebo ktoré ním prešlo (priepustnosť, T).
Absorbancia
Veličina, ktorá opisuje fenomén absorpcie, je absorbancia. Ide o bezrozmernú mieru intenzity elektromagnetického žiarenia vo vzťahu k počtu voľných atómov. Tento údaj bol zavedený na uľahčenie výpočtov týkajúcich sa absorpčných objemov. Absorpcia je interakcia medzi elektromagnetickým žiarením a hmotou – absorpcia časti energie hmotou. Absorbancia je aditívna a niekedy sa označuje ako optická hustota. Symbolicky sa zaznamenáva ako Abs alebo A. Matematicky je to dekadický logaritmus pomeru intenzity lúča žiarenia dopadajúceho na testovanú vzorku (I 0 ) k intenzite lúča žiarenia preneseného cez testovanú vzorku. (ja t ). Môže nadobúdať hodnoty od 0 do nekonečna. Matematický výraz popisujúci tento vzťah sa nazýva Beer-Lambertov zákon. Absorbancia pri danej vlnovej dĺžke závisí od absorpčného koeficientu (ε), hrúbky absorbujúcej vrstvy (zvyčajne 1 cm) a koncentrácie testovaného roztoku.
Priepustnosť
Priepustnosť je pomer ožiarenosti prechádzajúcej cez vzorku (I t ) k žiareniu dopadajúcemu na vzorku (I 0 ), ktorý sa rovná ožiarenosti prechádzajúcej cez referenčnú vzorku. Najčastejšie sa vyjadruje v percentách a môže sa pohybovať od 0 %do 100 %. Vyjadruje sa vzorcom: 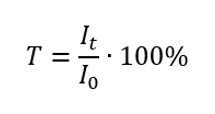 Vzťah medzi absorbanciou a priepustnosťou je vyjadrený takto:
Vzťah medzi absorbanciou a priepustnosťou je vyjadrený takto: 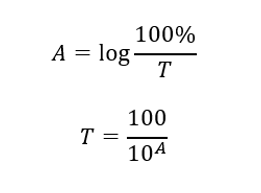
Lambertov zákon
Hovorí, že absorbancia je úmerná hrúbke absorbujúcej vrstvy homogénnej vzorky. Môže sa zaznamenať ako podiel koeficientu absorpcie (k) a hrúbky vrstvy meranej vzorky (l): 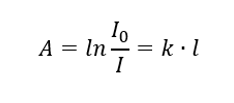

Beer-Lambertov zákon
Týka sa absorpcie žiarenia roztokmi a možno ho formulovať takto: ak je absorpčný koeficient rozpúšťadla nulový, potom je absorbancia monochromatického lúča žiarenia prechádzajúceho homogénnym roztokom priamo úmerná koncentrácii (c) roztoku. a na hrúbku absorbujúcej vrstvy (l). Beer-Lambertov zákon je definíciou absorbancie a možno ho napísať takto: 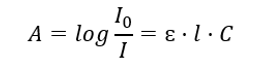 Molárny absorpčný koeficient (ɛ) je charakteristická hodnota látky v konkrétnom rozpúšťadle a pri určitej vlnovej dĺžke. Je úmerná pravdepodobnosti prechodov medzi energetickými hladinami molekuly a priamo závisí od energie fotónov žiarenia. V číselnom vyjadrení predstavuje absorbanciu, ktorú vykazuje roztok s koncentráciou 1 mol/dm 3 s hrúbkou absorbujúcej vrstvy 1 cm. Znalosť koeficientu umožňuje určiť koncentráciu testovaného roztoku po zmeraní veľkosti absorbancie. Voliteľne možno z koeficientu a koncentrácie vypočítať aj očakávanú absorbanciu roztoku. Vzorec sa používa hlavne na stanovenie koncentrácie látky so známym molárnym absorpčným koeficientom a empiricky meranou absorbanciou. Dá sa to urobiť pomocou vzorca alebo nakreslením kalibračnej krivky pre látku v niekoľkých bodoch v rozsahu očakávanej koncentrácie. Beer-Lambertov zákon možno prezentovať aj ako koncentračnú závislosť absorpcie: A = f(C).
Molárny absorpčný koeficient (ɛ) je charakteristická hodnota látky v konkrétnom rozpúšťadle a pri určitej vlnovej dĺžke. Je úmerná pravdepodobnosti prechodov medzi energetickými hladinami molekuly a priamo závisí od energie fotónov žiarenia. V číselnom vyjadrení predstavuje absorbanciu, ktorú vykazuje roztok s koncentráciou 1 mol/dm 3 s hrúbkou absorbujúcej vrstvy 1 cm. Znalosť koeficientu umožňuje určiť koncentráciu testovaného roztoku po zmeraní veľkosti absorbancie. Voliteľne možno z koeficientu a koncentrácie vypočítať aj očakávanú absorbanciu roztoku. Vzorec sa používa hlavne na stanovenie koncentrácie látky so známym molárnym absorpčným koeficientom a empiricky meranou absorbanciou. Dá sa to urobiť pomocou vzorca alebo nakreslením kalibračnej krivky pre látku v niekoľkých bodoch v rozsahu očakávanej koncentrácie. Beer-Lambertov zákon možno prezentovať aj ako koncentračnú závislosť absorpcie: A = f(C).
Zákon aditívnosti
Beer-Lambertov zákon sa vzťahuje na prípad, keď je v roztoku jedna absorbujúca látka. Ak je však vo viaczložkovom roztoku viac látok, ktoré absorbujú žiarenie zvolenej vlnovej dĺžky, absorbancia tohto roztoku (A) sa rovná súčtu absorbancií jeho jednotlivých zložiek (A 1 , A 2 ,…), tzn. A= A1 + A2 +⋯+ An . Stojí za zmienku a zapamätať si, že absorbancia každej zložky je súčinom jej koncentrácie a zodpovedajúceho molárneho absorpčného koeficientu. Toto je 3. zákon absorpcie, ktorý sa používa pri spektrofotometrickej analýze viaczložkových systémov.
Odchýlky od zákonov absorpcie
Predpokladom pre splnenie zákonov absorpcie je, aby žiarenie pôsobiace na systém bolo monochromatické a aby jeho intenzita nebola príliš vysoká. Dôvody odchýlenia sa od Beer-Lambertovho zákona môžu byť:
- nedokonalosť meracích prístrojov, ktorá má za následok nesplnenie podmienky,
- chemické reakcie prebiehajúce počas merania, napríklad polymerizácia , hydrolýza, kondenzácia,
- zákal roztoku.
Aplikácia elektrónových absorpčných spektier
- Umožňuje určiť typ elektrónových prechodov skúmaním spektier v rozpúšťadlách rôznej polarity.
- Rozdiely v polohe a intenzite absorpčných pásov rôznych molekulárnych foriem sa používajú na štúdium medzi nimi vytvorených rovnováh v roztoku ( štrukturálne štúdie , tautomérne rovnováhy).
- Používa sa na stanovenie zlúčenín na základe Beer-Lamberovho zákona.
- Používa sa ako dodatočná metóda identifikácie na základe polohy λ max testovaných látok.
- Používa sa pri určovaní čistoty testovaných zlúčenín – posunutie polohy absorpčného maxima, porovnanie pomeru hodnôt absorbancie v dvoch rôznych bodoch spektra.

UV-Vis elektrónová spektroskopia
Z hľadiska fenoménu absorpcie je UV-Vis spektrofotometria obzvlášť zaujímavou technikou, ktorá umožňuje kvalitatívnu a kvantitatívnu analýzu mnohých látok. Fenomén absorpcie žiarenia sa používa, keď: absorpcia závisí lineárne od koncentrácie alebo ak je absorpcia aditívna, tj pre viaczložkový roztok je to súčet absorpcií jeho zložiek. Podmienky sú splnené, keď v systéme nie sú žiadne medzimolekulové interakcie. Analýzou UV-Vis absorpčných spektier, ktoré sú výsledkom prechodu elektromagnetického žiarenia cez roztok, sa pozorujú prechody valenčných elektrónov zo zeme do excitovaného stavu. Tento jav má za následok absorpciu časti žiarenia pri určitých vlnových dĺžkach. Absorpcia je dôsledkom prechodu týchto elektrónov na vyššie energetické hladiny, ale aby sa tak stalo, musia mať kvantá elektromagnetického žiarenia dostatok energie na vyrovnanie energetického rozdielu medzi energetickými hladinami. V molekulách sú takéto energie niekoľko elektronvoltov, čo presne zodpovedá frekvencii UV-Vis.
Chromofory
Zlúčeniny, ktoré vykazujú absorpciu v oblasti UV-Vis, majú vo svojej štruktúre chromofóry, teda skupiny atómov, ktorých elektróny sa vyznačujú nízkou excitačnou energiou. Inými slovami, chromofor je časť molekuly (skupina atómov), ktorá je zodpovedná za selektívnu absorpciu žiarenia vo viditeľnej oblasti (180-800 nm) a tým za vznik farby. Patria sem: aromatické kruhy (aromatický elektrónový sextet), viacnásobné väzby (ich časť – väzby typu π), ako medzi atómami uhlíka, tak aj iné, napríklad karbonylová skupina C=O.
Auxochrómy
Ďalšou skupinou atómov sú auxochrómy, teda substituenty, ktoré nevykazujú absorpciu v oblasti UV-Vis, ale ich prítomnosť spôsobuje zmeny v spektrách absorbujúcich prvkov. Zosilňujú pôsobenie chromofórov, čo môžeme často pozorovať v podobe oveľa intenzívnejšieho zafarbenia testovanej látky ako v prípade ich neprítomnosti v systéme. Okrem toho delíme auxochrómy na batochrómy , napr. –NH 2 , -OH, ktoré posúvajú absorpčné maximum smerom k dlhším vlnovým dĺžkam, a hypsochrómy , ako sú –CH 3 , -CO, ktoré posúvajú maximum k kratším vlnovým dĺžkam.
Atómová absorpčná spektroskopia (AAS)
Toto je ďalšia technika využívajúca fenomén absorpcie. Slúži na stanovenie chemických prvkov vo forme vzoriek v akomkoľvek skupenstve (kvapalina, tuhá látka, plyn) a samotné meranie je založené na pozorovaní absorpcie žiarenia konkrétnej vlnovej dĺžky voľnými atómami kovov. Základom techniky je, že atóm dokáže pohltiť elektromagnetické žiarenie len s vlnovou dĺžkou, pri ktorej ho môže aj vyžarovať, a to je charakteristické len pre daný prvok. S vyššou energiou dodávanou atómu sú elektróny excitované na vyššie úrovne a v spektre je pozorovaný väčší počet čiar. Ak dodaná energia zodpovedá ionizačnému potenciálu atómu, tvoria sa ióny ako Na + . Základom kvantitatívnej analýzy atómovou absorpčnou spektrometriou je úmernosť absorbancie k počtu absorbujúcich atómov a Beer-Lambertov zákon.
