Stechiometria je odvetvie všeobecnej chémie, ktoré sa zaoberá výpočtami týkajúcimi sa kvantitatívneho priebehu chemických reakcií. Pri práci v laboratóriu je veľmi často potrebné vedieť, koľko (hmotnosť, objem, molekuly) substrátov musíme použiť, aby chemická reakcia, ktorú vykonávame, úplne prebehla alebo aby sme získali množstvo produktu. chceme. Niekedy je tiež potrebné vypočítať prebytok alebo nedostatok substrátu, ktorý spôsobil, že experiment prebiehal inak, ako sa očakávalo. Každý z týchto výpočtov vyplýva priamo z kvantitatívneho výkladu rovnice chemickej reakcie a využíva zákony zachovania hmotnosti. Tieto typy rovníc sa nazývajú stechiometrické výpočty.

Čo potrebujeme vedieť?
Aby sme mohli použiť stechiometriu, potrebujeme mať znalosti v mnohých oblastiach, vrátane: rovníc chemických reakcií, stechiometrických koeficientov, molových a molárnych hmotností a molárnych objemov plynov a Avogadrov zákon . Pomocou znalosti stechiometrie chemických reakcií je možné vyriešiť mnoho výpočtových problémov, ako napríklad:
- elementárna analýza,
- molárne výpočty,
- hmotnostné výpočty,
- výpočet nestechiometrických zmesí s možnosťou určenia limitujúcej látky v reakcii,
- reakčný výťažok.
Molárna hmota
Kvôli nepredstaviteľne malej hmotnosti jednotlivých atómov a molekúl vznikla jednotka (u) , vyjadrujúca atómovú hmotnosť. V praxi ide o hodnotu rovnajúcu sa 1/12 hmotnosti izotopu uhlíka 12 C. Táto časť látky úzko súvisí s Avogadrovou konštantou a je určená ako počet gramov látky, ktorá obsahuje 6,022,10 23 atómov, molekúl alebo iónov. Molárna hmotnosť [M] sa číselne rovná atómovej alebo molekulovej hmotnosti a jednotka je g/mol.
Molárny objem látky [Vm]
Toto je hodnota špecifická pre látku, ktorá silne závisí od teplotných a tlakových podmienok. Toto je objem látky, ktorý zaberá jeden mól. Za normálnych podmienok je prijatá konštantná hodnota 22,4 dm 3 .
Zákon konštantného zloženia a zachovania hmoty
Každá chemická zlúčenina, bez ohľadu na jej pôvod a spôsob jej získania, má presne definované a konštantné kvalitatívne a kvantitatívne zloženie. Oxid sírový napríklad vždy obsahuje 50 %hmotn. síry a oxid sírový 40 %hmotn. tohto prvku. V uzavretom systéme sa hmotnosť výsledných produktov rovná hmotnosti substrátov spotrebovaných počas reakcie. Zákon zachovania hmotnosti sa odráža v potrebe vyvážiť každú rovnicu chemickej reakcie príslušnými chemickými koeficientmi tak, aby dve strany rovnice boli rovnaké, pokiaľ ide o počet prítomných atómov. Stechiometrické pomery odrážajú molárne pomery reaktantov prítomných v chemickej reakcii.
Chemická reakčná rovnica
Všetky potrebné informácie o relatívnych vzťahoch medzi chemickými látkami sú odvodené z ich rovnice chemickej reakcie. Poskytuje niektoré dôležité relatívne a kvantitatívne informácie.
Príklad 1
Z rovnice pre syntézu amoniaku , ktorá nasleduje po reakcii: ![]() môžeme vykonať niekoľko interpretácií – molekulové, molárne, molové hmotnosti, molárne objemy a molekulové čísla. a) Molekulárne môžeme čítať, že tri molekuly vodíka reagujú s jednou molekulou dusíka za vzniku dvoch molekúl amoniaku. b) To tiež znamená, že tri móly vodíka reagujú s jedným mólom dusíka za vzniku produktu dvoch mólov amoniaku. c) Pomocou periodickej tabuľky chemických prvkov , ktorá obsahuje molárne hmotnosti jednotlivých atómov, môžeme tiež z rovnice vyvodiť záver, že 6 g vodíka úplne zreagovalo s 28 g dusíka za vzniku 34 g amoniaku. d) Potom za normálnych podmienok vieme, že jeden mól plynu zaberá 22,4 dm 3 . To nám umožňuje dospieť k záveru, že 67,2 dm 3 vodíka reaguje s 22,4 dm 3 dusíka za vzniku 44,8 dm 3 amoniaku. e) Ďalším užitočným vzťahom je Avogadrov zákon, ktorý hovorí, že rovnaké objemy rôznych plynov obsahujú rovnaký počet častíc za rovnakých podmienok tlaku a teploty. Keďže poznáme Avogadrovu konštantu 6,022·10 23 , vieme, že na uskutočnenie úplnej chemickej reakcie na syntézu amoniaku potrebujeme 3·6,022· 1023 molekúl vodíka a 6,022· 1023 molekúl dusíka. Reakciou sa získa 2,6,022,1023 molekúl amoniaku.
môžeme vykonať niekoľko interpretácií – molekulové, molárne, molové hmotnosti, molárne objemy a molekulové čísla. a) Molekulárne môžeme čítať, že tri molekuly vodíka reagujú s jednou molekulou dusíka za vzniku dvoch molekúl amoniaku. b) To tiež znamená, že tri móly vodíka reagujú s jedným mólom dusíka za vzniku produktu dvoch mólov amoniaku. c) Pomocou periodickej tabuľky chemických prvkov , ktorá obsahuje molárne hmotnosti jednotlivých atómov, môžeme tiež z rovnice vyvodiť záver, že 6 g vodíka úplne zreagovalo s 28 g dusíka za vzniku 34 g amoniaku. d) Potom za normálnych podmienok vieme, že jeden mól plynu zaberá 22,4 dm 3 . To nám umožňuje dospieť k záveru, že 67,2 dm 3 vodíka reaguje s 22,4 dm 3 dusíka za vzniku 44,8 dm 3 amoniaku. e) Ďalším užitočným vzťahom je Avogadrov zákon, ktorý hovorí, že rovnaké objemy rôznych plynov obsahujú rovnaký počet častíc za rovnakých podmienok tlaku a teploty. Keďže poznáme Avogadrovu konštantu 6,022·10 23 , vieme, že na uskutočnenie úplnej chemickej reakcie na syntézu amoniaku potrebujeme 3·6,022· 1023 molekúl vodíka a 6,022· 1023 molekúl dusíka. Reakciou sa získa 2,6,022,1023 molekúl amoniaku.
Príklad 2
Spaľovanie horčíka v chlóre prebieha podľa rovnice: ![]() nám umožňuje prísť s interpretáciami podobnými predchádzajúcemu príkladu. a) Už na prvý pohľad nám uvedená rovnica umožňuje dospieť k záveru, že na získanie jednej molekuly chloridu horečnatého musíme dodať jednu molekulu horčíka a jednu molekulu chlóru ako substráty. b) To je samozrejme ekvivalentné počtu mólov prítomných v systéme, tj jeden mól horčíka, jeden mól chlóru, jeden mól chloridu horečnatého. c) Pre hmotnostné výpočty vieme, že 24 g horčíka reaguje so 71 g chlóru za vzniku 95 g chloridu horečnatého. d) Keďže na uvažovanej chemickej reakcii sa zúčastňuje len jeden plyn, chlór , môžeme preň napísať aj to, že zaberá objem 22,4 dm 3 . e) V počte častíc sa každá zložka rovná druhej a má hodnotu 6,022·10 23 .
nám umožňuje prísť s interpretáciami podobnými predchádzajúcemu príkladu. a) Už na prvý pohľad nám uvedená rovnica umožňuje dospieť k záveru, že na získanie jednej molekuly chloridu horečnatého musíme dodať jednu molekulu horčíka a jednu molekulu chlóru ako substráty. b) To je samozrejme ekvivalentné počtu mólov prítomných v systéme, tj jeden mól horčíka, jeden mól chlóru, jeden mól chloridu horečnatého. c) Pre hmotnostné výpočty vieme, že 24 g horčíka reaguje so 71 g chlóru za vzniku 95 g chloridu horečnatého. d) Keďže na uvažovanej chemickej reakcii sa zúčastňuje len jeden plyn, chlór , môžeme preň napísať aj to, že zaberá objem 22,4 dm 3 . e) V počte častíc sa každá zložka rovná druhej a má hodnotu 6,022·10 23 . 
Percentuálny výťažok chemickej reakcie [ %W]
Stechiometrické výpočty sa používajú aj na zistenie výťažku reakcie, teda pomeru skutočného množstva získaného produktu k množstvu odvodenému z rovnice chemickej reakcie.
Príklad 1
Uskutočnila sa oxidačná reakcia 30 kg oxidu sírového a v prítomnosti platinového katalyzátora sa získalo 34 kg oxidu sírového. Aký bol výnos tohto procesu? Rovnica chemickej reakcie: ![]() Zo zaznamenanej reakcie môžeme vidieť, že dva móly oxidu sírového produkujú rovnaké množstvo mólov oxidu sírového. Keď poznáme molárne hmotnosti reaktantov, vieme, že stechiometricky, za predpokladu 100 %výťažku, 128 g S02 produkuje 160 g S03 . S týmito znalosťami môžeme usporiadať pomer: 0,128 kg SO 2 – 0,160 kg SO 3 30 kg SO 2 – x kg SO 3 Odtiaľto zistíme množstvo oxidu siričitého, ktoré by sa vyprodukovalo na 100 %. výnos.
Zo zaznamenanej reakcie môžeme vidieť, že dva móly oxidu sírového produkujú rovnaké množstvo mólov oxidu sírového. Keď poznáme molárne hmotnosti reaktantov, vieme, že stechiometricky, za predpokladu 100 %výťažku, 128 g S02 produkuje 160 g S03 . S týmito znalosťami môžeme usporiadať pomer: 0,128 kg SO 2 – 0,160 kg SO 3 30 kg SO 2 – x kg SO 3 Odtiaľto zistíme množstvo oxidu siričitého, ktoré by sa vyprodukovalo na 100 %. výnos. 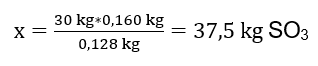 Keď poznáme teoretické a skutočné množstvo S03 , môžeme vypočítať výťažok, pri ktorom reakcia prebehla. 37,5 kg SO 3 – 100 %výťažok 34 kg SO 3 – x %výťažok
Keď poznáme teoretické a skutočné množstvo S03 , môžeme vypočítať výťažok, pri ktorom reakcia prebehla. 37,5 kg SO 3 – 100 %výťažok 34 kg SO 3 – x %výťažok 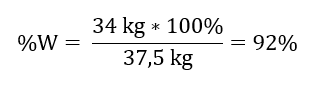 Oxidácia oxidu sírového na oxid sírový s použitím platinového katalyzátora sa uskutočnila s 92 %výťažkom.
Oxidácia oxidu sírového na oxid sírový s použitím platinového katalyzátora sa uskutočnila s 92 %výťažkom.
Molekulárne a elementárne vzorce
Ďalšou aplikáciou stechiometrických výpočtov je určenie vzorcov jednoduchých chemických zlúčenín. Molekulový vzorec chemickej zlúčeniny je identický s empirickým vzorcom alebo je jeho celočíselným násobkom. Ak vieme, že všeobecný vzorec chemickej zlúčeniny je N x O y , hodnoty stechiometrických indexov možno vypočítať vydelením hmotnosti na atómy ich atómovými hmotnosťami. Ak nie je známa molekulová hmotnosť chemickej zlúčeniny, ale iba jej percentuálne zloženie, možno uviesť iba elementárny vzorec. Môže to byť pravdivé znázornenie molekulového vzorca alebo len určiť pomer jednotlivých prvkov.
Príklad 1
Molekulová hmotnosť chemickej zlúčeniny je 92 u a pozostáva z 30,43 %dusíka a 69,57 %kyslíka. Aký je molekulárny vzorec chemickej zlúčeniny? Keďže súčet molekúl prítomných v zlúčenine je 100 %, môžeme predpokladať, že: 92 u – 100 %To nám umožňuje vypočítať jednotlivé obsahy prvkov: 92 u – 100 %xu dusíka – 30,43 %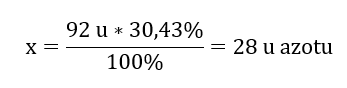 Vieme teda, že hmotnosť na atóm kyslíka je: 92 u – 28 u = 64 u Ak poznáme jednotlivé hmotnosti prvkov, môžeme určiť stechiometrické indexy:
Vieme teda, že hmotnosť na atóm kyslíka je: 92 u – 28 u = 64 u Ak poznáme jednotlivé hmotnosti prvkov, môžeme určiť stechiometrické indexy: 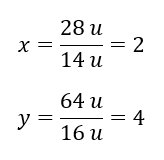 Molekulový vzorec tejto chemickej zlúčeniny je N204 .
Molekulový vzorec tejto chemickej zlúčeniny je N204 .
Príklad 2
V chemickej zlúčenine sú dva prvky – kyslík so 60%a 40 %síra. Aký je jeho elementárny vzorec? Všeobecný vzorec je SxOy , kde x je 40 %a y je 60 %. Keď poznáme molárne hmotnosti jednotlivých prvkov, možno to znázorniť takto: 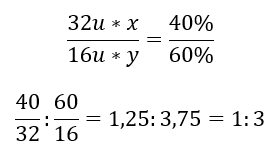 To znamená, že v danej chemickej zlúčenine pripadajú na každý jeden atóm síry tri atómy kyslíka. Elementárny vzorec je SO3 .
To znamená, že v danej chemickej zlúčenine pripadajú na každý jeden atóm síry tri atómy kyslíka. Elementárny vzorec je SO3 . 
Prebytočný a obmedzujúci substrát
V prípade reakcií, v ktorých sú reaktanty prítomné v pomeroch odlišných od ich zodpovedajúcej stechiometrie, jeden z reaktantov úplne zreaguje a reakcia sa zastaví. Potom je prítomný vo forme limitujúceho reaktantu, zatiaľ čo druhý reaktant bude v systéme v nadbytku a bude tiež stále prítomný v systéme vo svojej primárnej forme, keď je reakcia ukončená.
Príklad 1
V laboratóriu reagovalo 40 cm3 0,25 M roztoku síranu hlinitého s 50 cm3 0,5 M roztoku chloridu bárnatého. Koľko gramov zrazeniny sa vytvorí? Rovnica chemickej reakcie: ![]() Prvým krokom k poznaniu skutočného priebehu reakcie je určenie skutočného počtu mólov látok zapojených do reakcie. n Al2(SO4)2 : C Al2(SO4)2 · V Al2(SO4)2 = 0,25 · 0,04 dm 3 = 0,010 mol n BaCl2 : C BaCl2 · V BaCl2 = 0,5 · 0,05 dm 3 = 0,025 mol Druhým krokom je na stanovenie deficitného substrátu na základe stechiometrie reakcie – tým sa určí množstvo vytvorenej zrazeniny. 1mol Al 2 (SO 4 ) 3 – 3 mol BaCl 2 0,010 mol Al 2 (SO 4 ) 3 – x mol BaCl 2
Prvým krokom k poznaniu skutočného priebehu reakcie je určenie skutočného počtu mólov látok zapojených do reakcie. n Al2(SO4)2 : C Al2(SO4)2 · V Al2(SO4)2 = 0,25 · 0,04 dm 3 = 0,010 mol n BaCl2 : C BaCl2 · V BaCl2 = 0,5 · 0,05 dm 3 = 0,025 mol Druhým krokom je na stanovenie deficitného substrátu na základe stechiometrie reakcie – tým sa určí množstvo vytvorenej zrazeniny. 1mol Al 2 (SO 4 ) 3 – 3 mol BaCl 2 0,010 mol Al 2 (SO 4 ) 3 – x mol BaCl 2 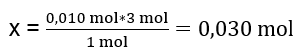 Na úplné uskutočnenie reakcie s 0,010 mol Al2 ( S04 ) 3 je potrebné pridať do systému 0,030 mol BaCl2 . Reaguje však len 0,025 mol chloridu bárnatého, čo znamená, že je v deficite a obmedzí reakciu. Preto by sa množstvo zrazeniny vytvorenej pri reakcii malo vypočítať z množstva tohto substrátu. Počet mólov chloridu bárnatého použitého podľa stechiometrie reakcie sa rovná počtu mólov vytvorenej zrazeniny, teda: n BaSO4 = n BaCl2 0,025 mol BaSO 4 = 0,025 mol BaCl 2 Poznanie počtu mólov bária síranu, môžeme vypočítať jeho hmotnosť: m BaSO4 = n BaSO4 · M BaSO4 m BaSO4 = 0,025mol · 233,393 g/mol = 5,835g Reakciami a množstvami substrátov uvedených v úlohe vznikne 5,835 g zrazeniny síranu bárnatého.
Na úplné uskutočnenie reakcie s 0,010 mol Al2 ( S04 ) 3 je potrebné pridať do systému 0,030 mol BaCl2 . Reaguje však len 0,025 mol chloridu bárnatého, čo znamená, že je v deficite a obmedzí reakciu. Preto by sa množstvo zrazeniny vytvorenej pri reakcii malo vypočítať z množstva tohto substrátu. Počet mólov chloridu bárnatého použitého podľa stechiometrie reakcie sa rovná počtu mólov vytvorenej zrazeniny, teda: n BaSO4 = n BaCl2 0,025 mol BaSO 4 = 0,025 mol BaCl 2 Poznanie počtu mólov bária síranu, môžeme vypočítať jeho hmotnosť: m BaSO4 = n BaSO4 · M BaSO4 m BaSO4 = 0,025mol · 233,393 g/mol = 5,835g Reakciami a množstvami substrátov uvedených v úlohe vznikne 5,835 g zrazeniny síranu bárnatého.
