När det gäller kemisk struktur tillhör alkaner gruppen kolväten. Dessa föreningar innehåller bara två typer av atomer: kol och väte. De är sammansatta av baskolramverket kopplat till väteatomer. Alkaner har bara enkelbindningar, varför de kallas mättade kolväten.

Homolog serie
Ordnade efter den växande mängden väteatomer i deras struktur bildar alkanrepresentanter en homolog serie. Det börjar med metan, som innehåller en kolatom, och slutar med dekan med nio kolatomer. Namnen på alkaner kommer från mängden kolatomer som finns i strukturen och definieras med grekiska eller latinska siffror samt den karakteristiska -anändelsen, som med heptan, nonan, etc. Den allmänna formeln för alkaner är följande: , där ‘n’ står för kol (C)-talet som finns i kedjan och ‘H’ representerar väteatomerna.
| Antalet kolatomer som finns i kedjan | Alkanformel | Alkannamn |
| 1 | CH 4 | Metan |
| 2 | C2H6 _ | Etan |
| 3 | C3H8 _ | Propan |
| 4 | C4H10 _ | Butan |
| 5 | C5H12 _ | Pentan |
| 6 | C6H 14 | Hexan |
| 7 | C7H 16 | Heptan |
| 8 | C8H 18 | Oktan |
| 9 | C9H20 _ | Ingen |
| 10 | C10H 22 | Decane |
Typer av mättade kolväten
När det gäller kedjestruktur skiljer vi följande typer av alkaner:
-
Linjära (paraffin) alkaner
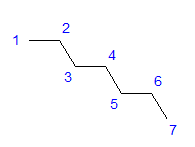 Fig. 1 Strukturformel för heptan Alla kolatomer visar sp 3 -hybridiseringen. På grund av en tetragonal vinkel mellan bindningarna krävs ett sicksackformat arrangemang av kolatomer. Molekyler kan ha olika arrangemang, eftersom fri rotation är möjlig runt en enkelbindning mellan kolatomer. Ju högre kolantal i strukturen, desto mer varierande kan kedjeformerna vara.
Fig. 1 Strukturformel för heptan Alla kolatomer visar sp 3 -hybridiseringen. På grund av en tetragonal vinkel mellan bindningarna krävs ett sicksackformat arrangemang av kolatomer. Molekyler kan ha olika arrangemang, eftersom fri rotation är möjlig runt en enkelbindning mellan kolatomer. Ju högre kolantal i strukturen, desto mer varierande kan kedjeformerna vara.
-
Isoalkaner: grenade mättade kolväten
Bildandet av grenade kolväten är effekten av att binda mellan en kolatom och mer än två andra kolatomer. En gren bildas vid punkten för en sådan länk. Grenade kolväten är linjära kolväteisomerer. 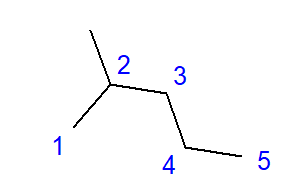 Fig. 2 Strukturformel för 2-metylpentan Formeln för 2-metylpentan som visas i Fig. 2 har totalt sex kolatomer och är en hexanisomer. Namnet ‘2-metylpentan’ betyder att pentankedjan har en länkad metylgrupp vid positionen för den andra kolatomen. Antalet möjliga strukturella isomerer växer tillsammans med det växande antalet kol. För att ge ett exempel kan hexan ha en struktur av 5 olika isomerer, oktan har 18 sådana möjligheter och hexan så många som 75.
Fig. 2 Strukturformel för 2-metylpentan Formeln för 2-metylpentan som visas i Fig. 2 har totalt sex kolatomer och är en hexanisomer. Namnet ‘2-metylpentan’ betyder att pentankedjan har en länkad metylgrupp vid positionen för den andra kolatomen. Antalet möjliga strukturella isomerer växer tillsammans med det växande antalet kol. För att ge ett exempel kan hexan ha en struktur av 5 olika isomerer, oktan har 18 sådana möjligheter och hexan så många som 75.
-
Cykliska kolväten: cykloalkaner, alicykliska kolväten
Det är möjligt att sluta kedjestrukturen samtidigt som man formar ringar som består av upprepade –CH 2 – element. Namnen är baserade på namnet på alkanen med prefixet ‘cyklo-‘, såsom cyklobutan eller cykloheptan. För att göra det enklare kan de presenteras som vanliga polygoner. 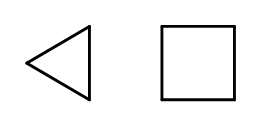 Fig. 3 Från vänster: cyklopropan, cyklobutan Det finns även ersättningsringar, vars namn inkluderar substituenterna. I detta fall är antalet kolatomer utformade på ett sådant sätt att placeringen av substituenter är möjligen låg.
Fig. 3 Från vänster: cyklopropan, cyklobutan Det finns även ersättningsringar, vars namn inkluderar substituenterna. I detta fall är antalet kolatomer utformade på ett sådant sätt att placeringen av substituenter är möjligen låg.
De viktigaste företrädarna
Metan är en förening med molekylformeln CH 4 , som börjar den homologa serien av alkaner. Kol är fyrvärt, så det har fyra CH-bindningar. Vid rumstemperatur är det en luktfri och färglös gas. Eftersom kolatomen visar sp 3 -hybridiseringen är den strukturerad som tetraeder, och de producerade orbitalerna bildar ekvivalenta bindningar tillsammans med fyra väteatomer. Etan är nästa alkan i serien, vars molekylformel är C 2 H 6 . När vi tittar på den semistrukturella formeln H 3 C-CH 3 kommer vi att märka att varje kolatom är kopplad till tre väteatomer. Precis som metan och andra lägre kolväten är det en färglös och luktfri gas. CH-bindningarna är frontala sigma sp-s-bindningar, medan en enkelbindning mellan kolatomer är en frontal sigma sp-sp-bindning.
Syntesen av alkaner
- Hydrogeneringen av alkener eller alkyner

- Hydrolysen av Grignard-föreningar
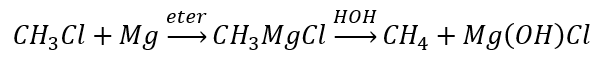
- Reduktionen av alkylhalider
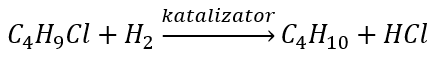
- Wurtz reaktion
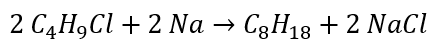
Reduktion av aldehyder och ketoner
- Clemmensen reducering
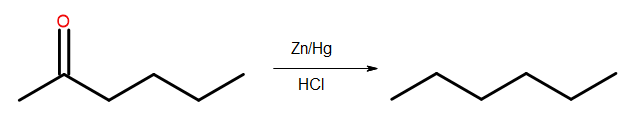 Fig. 4 Diagram över Clemmensen-reduktion
Fig. 4 Diagram över Clemmensen-reduktion
- Wolff-Kishners reaktion
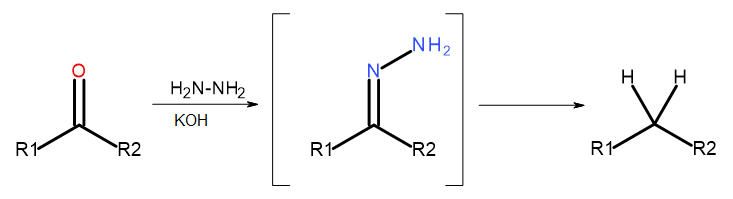 Fig. 5 Diagram av Wolff-Kishner
Fig. 5 Diagram av Wolff-Kishner
Alkanernas fysikalisk-kemiska egenskaper
Kortkedjiga alkaner från C 1 till C 4 vid rumstemperatur är gaser. Andra homologer (med början från pentan) är vätskor med en växande kokpunkt. De grenar som finns i strukturen resulterar i en lägre kokpunkt för isomerer. Beroendet av att lägga till ytterligare en –CH 2 – grupp i strukturen höjer kokpunkten runt 20–30 o C högre samtidigt som kolkedjans längd ökar. Aggregeringstillståndet för alkaner från oktadekan upp är fast med smältpunkter från 28 o C för n-oktadekan. Fasta kolväten inkluderar paraffin, medan högre flytande kolväten inkluderar paraffinolja. På grund av sin hydrofoba natur blandas inte alkanmolekyler med vatten, vätas inte av vatten och löser sig inte i vatten. Men med sin affinitet till opolära egenskaper löser de sig lätt i sig själva och i liknande icke-polära, medel- och lågpolära organiska lösningsmedel. Lösligheten av alkaner i två populära alkoholhaltiga lösningsmedel (metanol och etanol) är relativt god. I metanol löser sig alkaner bra endast upp till en specificerad koncentration. Överskottet av den koncentrationen gör att faserna separeras. I etanol löser sig lägre alkaner väldigt lätt, medan det är lite svårare att lösa högre alkaner. Högre kolväten är brandfarliga ämnen. Gasformiga kolväten såväl som par av flytande kolväten bildar blandningar med explosionspotential när de blandas med luften. Alkanernas reaktivitet är relativt låg på grund av bristen på potentiellt reaktiva funktionella grupper. Bindningarna mellan kolatomer (CC) såväl som mellan kolatomerna och syreatomerna (CH) är mycket motståndskraftiga mot klyvning. Energierna för dessa bindningar är 88 kcal/mol respektive 104 kcal/mol. De kan bara reagera abrupt under vissa förhållanden.
Alkanernas reaktioner
- Fullständig förbränning – med utsläpp av koldioxid
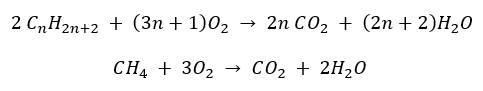
- Halvförbränning – med begränsat syre och utsläpp av kolmonoxid
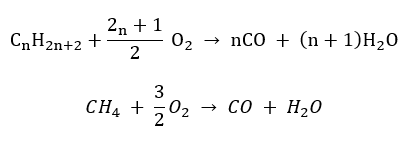
- Ofullständig förbränning – kimrök bildas med en mycket begränsad mängd syre
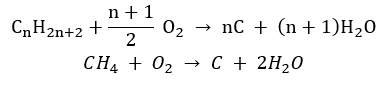
- Substitutionsreaktionen (radikal halogenering, exemplifierad av reaktionen av metan med klor med deltagande av ljus)
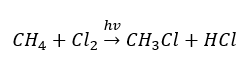
- Pyrolys är nedbrytning av alkaner till mindre molekyler vid en mycket hög temperatur. Beroende på processen kan sprickning, hydrokrackning eller isomerisering förekomma.
- Nitrering med användning av salpetersyra(V)syra och bildning av en blandning av produkter: isomerer med substituenten –NO 2 på olika platser.
- Tvåstegssulfonering, där mersoler är mellanprodukter och mersolaner är slutprodukten.
