Inom kemin bildar vissa kemiska föreningar speciella bindningar med vattenmolekyler. Dessa är inte kemiska bindningar, utan kortdistansinteraktioner som specifikt bestämmer egenskaperna hos dessa föreningar. Vi pratar om hydrater. Deras egenskaper används lätt inom utvalda industrisektorer. Det populäraste hydratiserade saltet är utan tvekan gips, eller kalciumsulfatdihydrat (VI), som är en viktig råvara i byggbranschen. Hydrater är också mycket bra indikatorer på fukthalt. Detta är relaterat till det faktum att färgen på det vattenfria saltet ofta skiljer sig från färgen på det hydratiserade saltet.

Återfuktar
Hydrater är inte kemiska föreningar där kemiska bindningar , såsom kovalenta bindningar , uppstår mellan vattenmolekylerna och molekylerna i det givna saltet . De är inte heller koordinationsföreningar. Bildandet av vätebindningar, som är mycket svagare i styrka än kemiska bindningar, är karakteristiskt för dessa strukturer. Hydrater är strukturerade i form av ett kristallgitter. Vattenmolekylerna är oregelbundet fördelade i den. Termen "kristallisationsvatten" används ofta. Hydrater erhålls genom hydrering . Saltmolekyler, särskilt oorganiska syraderivat, är mest benägna att genomgå denna reaktion. Hydrering innebär omvandling av vattenfria kristaller till hydratiserade. Det kan orsaka en förändring i mineralmassan, men förstör den inte. Hydrering åtföljs ofta av andra processer, såsom kolsyra. Hydrationskemikalier kännetecknas under normala förhållanden av hög hygroskopicitet , dvs en stark affinitet för vattenmolekyler. Sådana ämnen kan till exempel absorbera fukt från luften . Ett annat sätt att erhålla hydrater är att kristallisera dem från vattenhaltiga lösningar. De molekylära formlerna för hydrater bildas genom att skriva ner saltformeln och ange antalet hydratiserade vattenmolekyler. För att ge en allmän notation placeras bokstaven ‘n’ före ‘H 2 O’. Dess värden är större än ett och det motsvarar antalet anslutna vattenmolekyler. De vanligaste skillnaderna är mellan hydrater med n=½ (hemihydrat), n= 1 (monohydrat), n=2 (dihydrat) och n=3 (trihydrat). Viktigt är att samma ämne kan fästa olika antal vattenmolekyler. ![]()
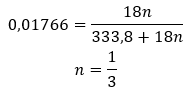 Med tanke på att det finns vätebindningar mellan saltmolekylerna och vattenmolekylerna uppvisar dessa föreningar inte tillfredsställande motståndskraft mot förhöjda temperaturer. När de värms upp sönderdelas de och övergår till vattenfria former. Hydrater löser sig mycket bra i vatten. I vattenlösningar frigörs hydratiserade vattenmolekyler fästa vid saltet. Detta faktum bör tas med i beräkningen, till exempel när man gör lösningar av dessa ämnen. Underlåtenhet att ta hänsyn till graden av hydratisering av en given förening resulterar i fel, om så bara vid bestämning av koncentrationen av lösningen. En viktig egenskap hos hydratiserade salter är förändringen i deras färg på grund av vidhäftningen av vattenmolekyler i hydratiseringsreaktionen. Det bör noteras att de hydratiserade formerna visar signifikant mindre hygroskopicitet jämfört med de vattenfria salterna.
Med tanke på att det finns vätebindningar mellan saltmolekylerna och vattenmolekylerna uppvisar dessa föreningar inte tillfredsställande motståndskraft mot förhöjda temperaturer. När de värms upp sönderdelas de och övergår till vattenfria former. Hydrater löser sig mycket bra i vatten. I vattenlösningar frigörs hydratiserade vattenmolekyler fästa vid saltet. Detta faktum bör tas med i beräkningen, till exempel när man gör lösningar av dessa ämnen. Underlåtenhet att ta hänsyn till graden av hydratisering av en given förening resulterar i fel, om så bara vid bestämning av koncentrationen av lösningen. En viktig egenskap hos hydratiserade salter är förändringen i deras färg på grund av vidhäftningen av vattenmolekyler i hydratiseringsreaktionen. Det bör noteras att de hydratiserade formerna visar signifikant mindre hygroskopicitet jämfört med de vattenfria salterna.
Hydrat av oorganiska föreningar
Salter av oorganiska syror är ämnen som är överlägset mest benägna att bilda hydrater med vattenmolekyler. De vanligaste hydraterna av oorganiska föreningar inkluderar:
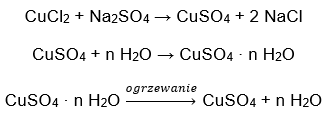
- Koppar(II)sulfathydrat (VI), CuSO 4 – koppar(II)sulfat (VI) antar olika grader av hydratisering. Det maximala antalet anslutna vattenmolekyler är fem. Som ett resultat av uppvärmningen av pentahydratet av detta salt tas vattenmolekyler av. Först bildas två och ett trihydrat, och vid ytterligare uppvärmning av systemet kan koppar(II)sulfatmonohydrat (VI) erhållas. För att ta bort den sista vattenmolekylen är det nödvändigt att värma föreningen till en temperatur på mer än 200 ᵒC. Koppar(II)sulfathydrater (VI) är blå till färgen, vilket orsakas av närvaron av kristallvatten runt kopparjonerna. Medan vattenfritt salt är vitt till färgen. Dess höga hygroskopicitet och förmåga att bilda hydrater används för att avlägsna fukt från vissa vätskor.
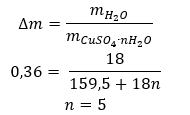
- Kobolt(II)kloridhydrat, CoCl 2 – vattenfri kobolt(II)klorid är mycket hygroskopisk. Tack vare sin starka affinitet för vattenmolekyler kan den absorbera fukt även från luften. Denna process resulterar i bildningen av hydrater av detta salt. Den vanligaste hydratiserade formen är kobolt(II)kloridhexahydrat – CoCl 2 * 6H 2 En annan form är dihydratmolekylen. Detta salt visar också förmågan att ändra färg beroende på dess fukthalt. Vattenfritt salt är blått, dihydrat får en rosa-lila färg och färgen på hexahydratmolekylen är intensivt röd.
- Natriumsulfathydrat (VI), Na 2 SO 4 – detta salt finns i form av två hydrater: heptahydrat (fem vattenmolekyler i strukturen) och dekahydrat (tio vattenmolekyler i strukturen). Den vattenfria formen av natriumsulfat (VI) förekommer i naturen som det sällsynta mineralet thénardit. Natriumsulfatten-hydrat (VI) är det så kallade Glaubersaltet. Det används i stor utsträckning vid tillverkning av glas, papper, tvättmedel och läsk. Glaubersalt är också en av ingredienserna som är nödvändiga för framställningen av det blå pigmentet ultramarin. Dessutom har föreningen en terapeutisk effekt på matsmältningssystemet på grund av dess laxerande egenskaper.

Gips
Ett exempel på ett oorganiskt salthydrat av global betydelse och bred användning är gips. Det är ett mineral som består av den hydratiserade formen av kalciumsulfat (VI), CaSO 4 . Kristallint gips är dihydratet av detta salt. Under naturliga förhållanden bildas det under avdunstning av saltvatten från sjöar och floder, vid temperaturer under 42ᵒC. Vattenfritt kalciumsulfat (VI) är anhydrit. Det kallas också för vattenfritt gips. Bygggips är å andra sidan kalciumsulfathemihydrat (VI). Vilken form av detta salt som erhålls beror på den temperatur som råder under bearbetningen av den ursprungliga sedimentära bergarten. Gips som används i byggandet är vanligtvis en blandning av olika former av hydratiserat kalksalt. 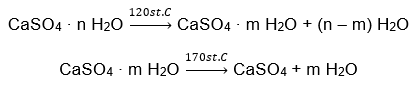
 Användningsmöjligheterna för gips är mycket breda, speciellt inom byggbranschen. De viktigaste användningsområdena för detta salthydrat listas nedan:
Användningsmöjligheterna för gips är mycket breda, speciellt inom byggbranschen. De viktigaste användningsområdena för detta salthydrat listas nedan:
- Inom byggbranschen används gips i ytbehandlingselement. Det är en av komponenterna i lösa halvfabrikat, murbruk, lim, gipsbaserad ytbehandling och färdigblandade monteringskomponenter, t.ex. gipsskivor.
- Medicin använder gips för att stödja trasiga lemmar. Gipsbandage anses vara hudvänliga. Dessutom används materialet även i tandtekniska laboratorier.
- Industrin använder gips i modellerings- och designverkstäder. Gipsavgjutningar är mycket lämpliga för att forma olika nyttoföremål.
- Gips är en tillsats till vissa gödselmedel som används inom jordbruket.

Metan klatrater
Metanklatrater tillhör en grupp föreningar som kallas gashydrater. De är ansvariga för det mesta av de snabba klimatförändringarna i jordens historia. Metanklatrater kallas också ofta för metanhydrater eller metanis. De bildar en fast form av vatten och metan . Deras molekyler kännetecknas av deras kristallina struktur. De bildas under ökat tryck. De tar formen av vita, luktfria fasta ämnen, som ofta liknar is, vad gäller yttre utseende. Intressant nog liknar de polystyren vid beröring. Klatrater är unika kemiska grupperingar . Vattenmolekyler bildar en struktur som liknar en bur. Metan lagras inuti denna bur. Viktigt är att de två ämnena inte bildar kemiska bindningar med varandra. Vanligtvis består metanklatrater av 46 vattenmolekyler som omger två små och sex medelstora burar. Metanmolekyler är fångade inuti dem. Klatrater är också kända för att bestå av 136 vattenmolekyler med 16 små och åtta stora burar av metangas inuti. Under de senaste åren har betydande mängder av denna resurs upptäckts på botten av haven. Det väcker stort intresse på grund av potentialen att utvinna betydande mängder metan, som kan användas till exempel för energiändamål. Metanklatrater brinner med en jämn låga, rödaktig till färgen. Efter förbränning finns smält vatten kvar. Metan som utvinns på detta sätt kan vara ett bra alternativ till konventionella kolvätekällor , men det är också ett stort hot mot klimatet. Det finns fortfarande otillräcklig kunskap om utnyttjandet av metan från klatrater som samlats på havsbotten. Okontrollerat utsläpp av betydande mängder av denna gas kan vara mycket farligt, eftersom det förstärker växthuseffekten mycket starkare än koldioxid.
