Dissociation, i kemiskt sammanhang, betyder nedbrytning av ett ämne till andra molekyler. Ordet kommer från det latinska ordet " dissociatio ", som betyder "separation". I den vetenskapliga nomenklaturen har dissociation olika definitioner, eftersom det också har sin specifika betydelse inom psykologi. Men låt oss fokusera på vad dissociation betyder i kemi. Beroende på processens förlopp och vilket ämne som används kan vi urskilja fyra olika typer av dissociation. Den mest populära är elektrolytisk dissociation, även om termisk dissociation är lika viktig.

Termisk dissociation
Processen består i sönderdelning av molekyler till mindre molekyler eller till atomer, under inverkan av temperaturen. Det viktigaste sambandet är det faktum att temperaturen som används för dissociation kan vara lägre om föreningen innehåller svagare kemiska bindningar. De med högre energi som krävs för nedbrytning kräver högre temperatur. Ett vanligt exempel på termolys (termisk dissociation) är karamelliseringen av sackaros, som sker vid 160 oC .
Elektrolytisk dissociation
Upptäckt 1887 av den svenska kemisten Svante Arrhenius, är det något mer komplext jämfört med termisk dissociation. Elektrolytisk dissociation består i sönderdelning av ett ämne, vilket sker när ett lösningsmedel (vanligtvis vatten) påverkar fritt rörliga joner. Arrhenius har i sin forskning bevisat att joner som produceras av sådan dissociation gör att lösningen leder elektricitet. Detta var grunden för att utveckla klassificeringen av kemiska ämnen i elektrolyter (lösningar som kan leda elektrisk ström) och icke-elektrolyter (lösningar som inte kan leda elektrisk ström).
Elektrolyter
Termen "elektrolyter" har två betydelser – ur teknisk synvinkel är det vilken substans som helst som joniskt kan överföra en laddning mellan elektroderna. Som ett resultat kan den leda elektrisk ström joniskt. Den andra, mer kemiska betydelsen av denna term hänvisar till ämnen som genomgår elektrolytisk dissociation till följd av smältning eller upplösning. Sådana lösningar (oftast vattenhaltiga) leder också elektricitet. Exempel på sådana elektrolyter inkluderar joniska föreningar, såsom natriumklorid (bordssalt), men även icke-joniska föreningar, till exempel saltsyra eller kaliumhydroxid . Med tanke på deras specifika egenskaper kan elektrolyter kallas elektriska ledare. Dessa kan delas in i klass 1-ledare (metaller, deras legeringar och kol) och klass 2-ledare (lösningar av baser, syror och salter ).
Mekanismen för elektrolytisk dissociation
I ett lösningsmedel vars dielektricitetskonstant är hög (t.ex. 81 för vatten), reduceras krafterna för ömsesidig attraktion mellan joner i ett kristallint nätverk avsevärt. Det är då jonerna bryter av, vilket gör att ämnet löses upp och utsöndrar fritt rörliga joner i lösningen. Sådana processer uppstår också på grund av växelverkan mellan joner och vattenmolekyler, som är en följd av en polär struktur av H 2 O. Enligt Nekrasov startas verkningsmekanismen för vatten under sönderdelningen av en elektrolyt med jonstruktur av ämnets positiva jon, som attraherar vattenmolekylens motsatta pol, samtidigt som den trycker bort den positiva jonen. Den motsatta polen fungerar på samma sätt, och båda jonerna omges av vattenmolekylerna de har attraherat. Sådan attraktion sker i båda riktningarna mellan dipolära molekyler och joner, vilket gör att jonernas attraktionskraft i elektrolyten blir mycket lägre. Således kan mekanismen delas in i fyra huvudstadier: övergången av polär till jonstruktur, bildandet av jonstrukturen och hydratisering av joner. Länkarna mellan jonerna och lösningsmedlet, som produceras genom dissociation, kallas solvat. Om vatten är lösningsmedlet kallas de hydrater.
Hydratiseringsskalet
Det är ett skal som består av vattenmolekyler som finns i jonens närmaste närhet, orienterade med sina motsatta poler. Fria, laddade poler attraherar ytterligare vattenlager, tills jonens attraktionskraft blir svagare än den molekylära rörelseenergin i lösningen. Skalet underlättar nedbrytningen av elektrolytmolekyler till katjoner och anjoner, och utgör en barriär som hindrar återkopplingen av joner för att bilda molekyler. 
Dissociation av syror och baser: lagen om massverkan
Starka syror är de syror som visar långtgående dissociation i en vattenlösning, och svaga syror är de som dissocierar endast i liten utsträckning. Om vi jämför styrkan hos olika syror bör vi också ta hänsyn till några faktorer som syramolekylernas tendens att ge bort sina protoner, eller koncentrationen av ämnet i fråga. Det finns dock ett kemiskt värde som inte beror på koncentrationen utan utmärkt karakteriserar individuella egenskaper hos molekyler – dissociationskonstanten. Att härleda ekvationen för det värdet bör börja med att skriva ekvationen för syradissociation . För ett exempel med en enda proton (HX), kommer det att se ut så här: ![]() Om lösningen är utspädd och syran är svag, kan vi tillämpa lagen om massverkan, som uttrycks enligt följande:
Om lösningen är utspädd och syran är svag, kan vi tillämpa lagen om massverkan, som uttrycks enligt följande: 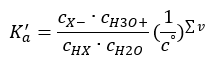 Det finns två sätt att göra den presenterade relationen kortare. Det första steget är att anta att vattenkoncentrationen är konstant. Vi kan också utelämna symbolen c o , eftersom den uttrycker en standardkoncentration lika med 1 mol/dm 3 . Det är dock viktigt att placera det i den initiala formeln och att ta hänsyn till det när man bestämmer enheten. Detta beror på att kemiska konstanter är dimensionslösa värden. Under tiden är alla koncentrationer som används i formeln uttryckta i mol/dm 3 . Sedan får vi slutligen formeln för dissociationskonstanten:
Det finns två sätt att göra den presenterade relationen kortare. Det första steget är att anta att vattenkoncentrationen är konstant. Vi kan också utelämna symbolen c o , eftersom den uttrycker en standardkoncentration lika med 1 mol/dm 3 . Det är dock viktigt att placera det i den initiala formeln och att ta hänsyn till det när man bestämmer enheten. Detta beror på att kemiska konstanter är dimensionslösa värden. Under tiden är alla koncentrationer som används i formeln uttryckta i mol/dm 3 . Sedan får vi slutligen formeln för dissociationskonstanten: 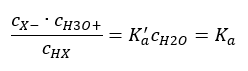 Förhållandet som uttrycker syradissociationskonstanten ( Ka ) består av värden bestämda genom experiment, vilka ligger inom intervallet 10 -10 till 10 8 . En populär operation är att använda en logaritmisk formel, uttryckt som en negativ logaritm av dissociationskonstanten, betecknad som pK a : pK a = -logK a Det är viktigt att medan låga K a -värden representerar svaga syror, och höga värden representerar starka syror , ändras pK a på motsatt sätt. Låga, vanligtvis negativa pK a -värden motsvarar starka syror. Positiva, höga pKa -värden representerar svaga syror. När vi introducerar ett annat begrepp, graden av dissociation (α), som är förhållandet mellan antalet mol av molekylerna i en given förening, som genomgår dissociation (nedbrytning till joner), och det totala antalet mol av molekylerna av den föreningen, som finns i lösningen, kan vi vidareutveckla ekvationen. Om vi bortser från den mycket låga koncentrationen av vätejoner som bildas av vattendissociation och använder jämviktskoncentrationerna av joner och molekyler, kan vi anta att:
Förhållandet som uttrycker syradissociationskonstanten ( Ka ) består av värden bestämda genom experiment, vilka ligger inom intervallet 10 -10 till 10 8 . En populär operation är att använda en logaritmisk formel, uttryckt som en negativ logaritm av dissociationskonstanten, betecknad som pK a : pK a = -logK a Det är viktigt att medan låga K a -värden representerar svaga syror, och höga värden representerar starka syror , ändras pK a på motsatt sätt. Låga, vanligtvis negativa pK a -värden motsvarar starka syror. Positiva, höga pKa -värden representerar svaga syror. När vi introducerar ett annat begrepp, graden av dissociation (α), som är förhållandet mellan antalet mol av molekylerna i en given förening, som genomgår dissociation (nedbrytning till joner), och det totala antalet mol av molekylerna av den föreningen, som finns i lösningen, kan vi vidareutveckla ekvationen. Om vi bortser från den mycket låga koncentrationen av vätejoner som bildas av vattendissociation och använder jämviktskoncentrationerna av joner och molekyler, kan vi anta att: 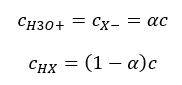 Då kan dissociationskonstanten noteras enligt följande:
Då kan dissociationskonstanten noteras enligt följande:  I denna form är det beroendet av graden av dissociation av en elektrolyt från dess koncentration, dvs Ostwalds utspädningslag. Om vi analyserar mycket svaga elektrolyter kan dissociationsgraden (α) antas vara <<1, och formeln kan förenklas till följande:
I denna form är det beroendet av graden av dissociation av en elektrolyt från dess koncentration, dvs Ostwalds utspädningslag. Om vi analyserar mycket svaga elektrolyter kan dissociationsgraden (α) antas vara <<1, och formeln kan förenklas till följande:  Syror som innehåller mer än en proton genomgår dissociation i flera steg, och vi måste ta hänsyn till alla dess stadier. För att ge ett exempel, för ortofosforsyra finns det tre steg:
Syror som innehåller mer än en proton genomgår dissociation i flera steg, och vi måste ta hänsyn till alla dess stadier. För att ge ett exempel, för ortofosforsyra finns det tre steg:
- H3PO4 + H2O = H2PO4- + H3O +
- H2PO4- + H2O = HPO42- + H3O +
- HPO42- + H2O = PO43- + H3O +
Varje steg har sin egen jämviktskonstant, som kan noteras analogt med den första:  Dissociationskonstanter finns i tabellform, både för hydracider och för oxysyror.
Dissociationskonstanter finns i tabellform, både för hydracider och för oxysyror.
| Syra | K a | pK a |
| HF | 6,3· 10-4 | 3.2 |
| HCl | 1·10 7 | -7 |
| HNO 3 | 27,54 | -1,44 |
| H 3 PO 4 | 6,9·10 -3 | 2.16 |
Tabell 1. Exempelvärden på dissociationskonstanter för syror. Det är liknande för stabiliseringen av basernas jämvikt under dissociation. Med tanke på exempelregel B kan ekvationen noteras enligt följande: ![]() Om vi sedan vill härleda en dissociationskonstant för en bas, genom att använda lagen om massverkan och anta att vattenkoncentrationen i den utspädda lösningen är praktiskt taget konstant, får vi följande formel:
Om vi sedan vill härleda en dissociationskonstant för en bas, genom att använda lagen om massverkan och anta att vattenkoncentrationen i den utspädda lösningen är praktiskt taget konstant, får vi följande formel:  Ju starkare basen är, desto högre dissociationskonstanten och desto lägre är pKb- värdet, medan ju lägre dissociationskonstanten och ju högre pKb- värdet är, desto svagare är basen.
Ju starkare basen är, desto högre dissociationskonstanten och desto lägre är pKb- värdet, medan ju lägre dissociationskonstanten och ju högre pKb- värdet är, desto svagare är basen.
| Bas | K b | pK b |
| Hydrazin | 3·10 -6 | 5.5 |
| Ammoniak | 1,78·10 -5 | 4,75 |
| Metylamin | 5,0· 10-4 | 3.3 |
Tabell 2. Exempelvärden på dissociationskonstanter för baser. 
Vad bestämmer syrors styrka
Om vi känner till uttrycken för dissociationskonstanter för särskilda syror, kan vi göra några sanna antaganden:
- Styrkan hos en hydrsyra ökar tillsammans med det ökande atomnumret för grundämnet kopplat till väteatomen.
- Styrkan hos en hydrsyra minskar tillsammans med den ökande elektronegativiteten hos elementet fäst vid väteatomen. Detta kan vara missvisande, eftersom den ökande elektronegativiteten i teorin borde gynna abstraktionen av protoner.
- Storleken på anjonen som bildas under dissociation påverkar dissociationskonstanten i större utsträckning än elektronegativitet.
Självdissociation av vatten
Ett intressant exempel på dissociation är nedbrytningen av vattenmolekyler. Eftersom de kan både dra protoner och ge bort dem, genomgår rent vatten självdissociation i liten utsträckning, enligt följande ekvation: H 2 O + H 2 O ↔ H 3 O + + OH – Som för syror och baser är det också möjligt att tillämpa lagen om massverkan, som inkluderar jämviktskoncentrationer av icke-dissocierat vatten såväl som dess anjoner och katjoner: 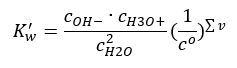 Det visar sig att koncentrationerna av H 3 O + katjoner och OH – anjoner är så små jämfört med icke-dissocierat vatten att ens deras förändring praktiskt taget inte förändrar koncentrationen av icke-dissocierat vatten. Detta gör det möjligt att anta att värdet är konstant och att omvandla ekvationen till följande form: K w = c OH – · c H3O + Det är en särskilt viktig aspekt i samband med kemiska beräkningar, och en sådan konstant hänvisas till till som den joniska produkten av vatten. Det används också ofta som en negativ logaritm, betecknad som pK w . Detta är lika med –logK w . Baserat på ekvationen, om den joniska jämvikten i vatten störs som ett resultat av tillförsel av H 3 O + -joner, måste vi för att bibehålla den joniska produktens konstanthet minska koncentrationen av OH – joner. På liknande sätt minskar ett överskott av OH – joner koncentrationen av katjoner. Produkten av dessa koncentrationer måste vara konstant. Experiment har visat att Kw vid en temperatur av 298K är 10 -14 . Därför kan vi också notera ekvationen som gäller för rent vatten enligt följande:
Det visar sig att koncentrationerna av H 3 O + katjoner och OH – anjoner är så små jämfört med icke-dissocierat vatten att ens deras förändring praktiskt taget inte förändrar koncentrationen av icke-dissocierat vatten. Detta gör det möjligt att anta att värdet är konstant och att omvandla ekvationen till följande form: K w = c OH – · c H3O + Det är en särskilt viktig aspekt i samband med kemiska beräkningar, och en sådan konstant hänvisas till till som den joniska produkten av vatten. Det används också ofta som en negativ logaritm, betecknad som pK w . Detta är lika med –logK w . Baserat på ekvationen, om den joniska jämvikten i vatten störs som ett resultat av tillförsel av H 3 O + -joner, måste vi för att bibehålla den joniska produktens konstanthet minska koncentrationen av OH – joner. På liknande sätt minskar ett överskott av OH – joner koncentrationen av katjoner. Produkten av dessa koncentrationer måste vara konstant. Experiment har visat att Kw vid en temperatur av 298K är 10 -14 . Därför kan vi också notera ekvationen som gäller för rent vatten enligt följande:  Dissociation är också relaterat till lösningens pH-värde. Lösningar med lika koncentrationer av H 3 O + katjoner och OH – anjoner visar ett neutralt pH. I sura lösningar är koncentrationen av katjoner högre än 10 -7 mol/l, medan den i alkaliska lösningar är lägre än 10 -7 mol/l.
Dissociation är också relaterat till lösningens pH-värde. Lösningar med lika koncentrationer av H 3 O + katjoner och OH – anjoner visar ett neutralt pH. I sura lösningar är koncentrationen av katjoner högre än 10 -7 mol/l, medan den i alkaliska lösningar är lägre än 10 -7 mol/l.
