Om man tittar på deras struktur är karboxylsyror viktiga organiska föreningar, och de är acylderivat. De är ett slags byggmaterial för många derivat, inklusive estrar och amider. I naturen kan vi hitta en hel rad olika karboxylsyror, såsom ättiksyra CH 3 COOH, som är den grundläggande föreningen i bordsvinäger, smörsyra CH 3 CH 2 CH 2 COOH som ansvarar för lukten av härskt smör, eller mer komplex cholsyra, som är den grundläggande komponenten i mänskliga gallsafter.

Den allmänna formeln för karboxylsyror är:
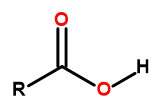
Figur1 Den allmänna formeln för karboxylsyror är:
Nomenklatur för karboxylsyror
Enligt IUPAC-nomenklatursystemet kan karboxylsyror namnges på två sätt, beroende på molekylens storlek och komplexitet. Syror som är alifatiska derivat namnges systematiskt genom att ändra alkanändelsen från -an till -oic och lägga till det initiala ordet "syra", till exempel propansyra, butansyra, 3-etyl-6-metyloktandisyra. Numreringen av kolatomer i sådana kemiska föreningar börjar alltid med atomen i den funktionella gruppen –COOH. Det andra namngivningssystemet, särskilt användbart för syror där karboxylgruppen är fäst vid ringen, tillåts att lägga till orden "syra" före och "karboxylsyra" efter den till det systematiska namnet på föreningen. I sådana fall börjar numreringen av kolatomerna med den atom till vilken karboxylgruppen är bunden, som i sig behandlas som en substituent.
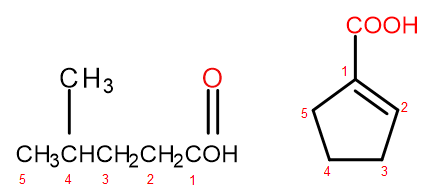
Figur 2 Numrering av kolatomer i, från vänster till höger: 4-metylpentansyra, 1-cyklopentenkarboxylsyra.
| Karboxylsyra | Acylgrupp | ||
| Strukturera | namn | Strukturera | namn |
| HCOOH | Myr | HCO- | Formyl- |
| CH3COOH | Ättik | CH 3 CO- | Acetyl- |
| CH 3 CH 2 CH 2 COOH | Smörsyra | CH 3 CH 2 CH 2 CO- | Butyryl- |
| HOOCKHOH | Oxalsyra | -OCCO- | Oxalil- |
| HOOC( CH2 ) 2COOH | Succinic | -OC (CH2) 2CO- | succinyl- |
Karboxylsyrors struktur och fysikaliska egenskaper
Likheten mellan karboxylgruppen och både ketoner och alkoholer kan antyda liknande fysikaliska egenskaper. Liksom i ketoner har kolatomen i den funktionella gruppen en sp2- hybridisering. Detta är direkt relaterat till dess platta struktur och vinklar på cirka 120 o mellan CCO- och OCO-bindningarna. Till exempel har ättiksyra CH 3 COOH bindningsvinklar lika med:
- 119 o för CC=O,
- 119 o för CC-OH,
- 122° för O =C-OH.
Bindningslängderna är som följer:
- 52Å för CC,
- 25Å för C=O,
- 31 Å för C-OH.
Karboxylsyror visar sin likhet med alkoholer på grund av deras starka associativitet orsakad av möjligheten att bilda vätebindningar. I praktiken existerar de flesta av dessa föreningar som cykliska dimerer vars struktur upprätthålls genom bildandet av vätebindningar. Ett sådant specifikt system av vätebindningar påverkar också kokpunkterna för karboxylsyror. Det orsakar deras betydande ökning jämfört med motsvarande alkoholer. Till exempel fysikaliska konstanter – smältpunkten och kokpunkten i grader Celsius är respektive:
- Myrsyra : 8,4; 100,7,
- Ättiksyra: 16,6; 117,9,
- Propansyra: -20,8; 141,
- Bensoesyra: 122,1; 249.
Dissociation av karboxylsyror
De sura egenskaperna hos denna grupp av föreningar gör det möjligt för dem att reagera med baser, inklusive natriumhydroxid och kaliumbikarbonat. Produkterna av sådana reaktioner är salter av karboxylsyror. Lösligheten av karboxylsyror i vatten är försumbar, men deras salter med alkalimetaller löser sig på grund av sin jonstruktur mycket bra i vatten. Dessa föreningar, som är syror i Brönsted-Lowry-teorin, dissocierar i utspädda vattenlösningar. Som ett resultat av omvandlingen bildas karboxylatanjonen RCOO – och hydroniumkatjonen H 3 O + .
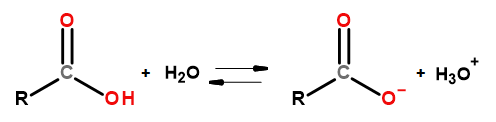
Figur 3 Schema för karboxylsyradissociation.
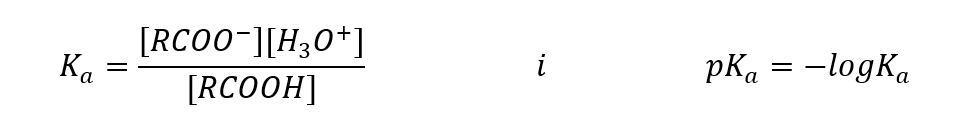 Empiriskt bestämda värden för karboxylsyror visar att de är svagt dissocierade föreningar, så i praktiken är de också svaga syror. För de flesta av dem tar K a -konstanten ett värde på cirka 10 -5 . För ättiksyra Ka = 1,76·10 -5 , vilket efter omvandling ger pK ett värde lika med 4,75. Detta motsvarar dissociationen av endast cirka 0,1 %av molekylerna, vilket, jämfört med starka oorganiska syror med en dissociationsgrad på 100 %, bekräftar att dessa är låghållfasta syror. Jämfört med alkoholer, vars jämviktskonstanter oscillerar i storleksordningen 10 -16 , är karboxylsyror mycket starkare. Trots deras strukturella likhet beror detta faktum på stabiliteten hos karboxylatanjonen i förhållande till alkoxidanjonen. Observera att den negativa laddningen i alkoxider finns på en enda syreatom, vilket är mycket elektronegativt. Däremot i karboxylatanjoner delokaliseras laddningen mellan de två syrgaserna i den funktionella gruppen. Detta gör den mer stabil jämfört med anjonen som produceras av alkoholer.
Empiriskt bestämda värden för karboxylsyror visar att de är svagt dissocierade föreningar, så i praktiken är de också svaga syror. För de flesta av dem tar K a -konstanten ett värde på cirka 10 -5 . För ättiksyra Ka = 1,76·10 -5 , vilket efter omvandling ger pK ett värde lika med 4,75. Detta motsvarar dissociationen av endast cirka 0,1 %av molekylerna, vilket, jämfört med starka oorganiska syror med en dissociationsgrad på 100 %, bekräftar att dessa är låghållfasta syror. Jämfört med alkoholer, vars jämviktskonstanter oscillerar i storleksordningen 10 -16 , är karboxylsyror mycket starkare. Trots deras strukturella likhet beror detta faktum på stabiliteten hos karboxylatanjonen i förhållande till alkoxidanjonen. Observera att den negativa laddningen i alkoxider finns på en enda syreatom, vilket är mycket elektronegativt. Däremot i karboxylatanjoner delokaliseras laddningen mellan de två syrgaserna i den funktionella gruppen. Detta gör den mer stabil jämfört med anjonen som produceras av alkoholer.
Erhålla karboxylsyror
- Oxidation av substituerade alkylbensener med KMnO 4 eller Na 2 Cr 2 O 7 med produkten i form av substituerade bensoesyror. Det är möjligt att oxidera primära och sekundära alkylgrupper,
- Oxidation av C=C-bindningen i alkener med minst en vinylväteatom med användning av KMnO 4 ,
- Oxidation av primära alkoholer och aldehyder. Alkoholer som använder Jones-reagenset, aldehyder som använder samma reagens och basisk silveroxid,
- Hydrolys av nitriler under inverkan av starka, heta lösningar av syror eller baser,
- Reaktionen av Grignard-föreningar med koldioxid, med en mellanprodukt i form av magnesiumkarboxylat. Övergångsföreningen reagerar sedan med syran.
Reaktioner av karboxylsyror
På grund av sin struktur genomgår karboxylsyror, förutom sina karakteristiska reaktioner, också omvandlingar som liknar alkoholer och ketoner. Liksom alkoholer kan de dissociera en proton för att bilda ett nukleofilt reagens. Liksom ketoner utsätts de för attacker av andra nukleofiler på kolatomen i karbonylgruppen. Dessutom är deras reduktion, substitution i alfapositionen, nukleofil substitution av acylgruppen och deprotonering (dissociation) möjliga. Reduktion av karboxylsyror sker med LiAlH 4 , vilket ger produkten som en primär alkohol. Ibland är det nödvändigt att applicera uppvärmning i en tetrahydrofuranlösning för att öka effektiviteten. En annan metod är en reduktion med boran i tetrahydrofuranlösning, varvid också 1 o alkoholer erhålls.
