Per definition är kemisk aktivitet ett elements förmåga att donera elektroner i kemiska reaktioner. I praktiken ökar deras aktivitet med minskande elektronegativitet - ett mått på ett elements förmåga att attrahera elektroner. Om en metall inte drar till sig elektroner starkt är den mer reaktiv. Ett referenselement, väte, används för att klassificera den kemiska aktiviteten hos metaller. Ett mått på en metalls aktivitet är dess förmåga att ersätta väte från syror eller väte från en vattenmolekyl.

Kemisk aktivitet serie av metaller
Denna term används för att beskriva sammanfattningen av kemiska grundämnen som är metalliska till sin natur , i en specifik ordning från minst till mest kemiskt aktiva. Detta används för att jämföra aktiviteten hos olika metaller. Förutom metaller innehåller den kemiska aktivitetsserien även en icke-metall, väte , som är referenselementet. Ju högre upp i aktivitetsserien en metall är, desto mer reaktiv är den . Det är också relaterat till att det är lättare att oxidera och därför ett starkare reduktionsmedel och ett mer kemiskt aktivt grundämne. Ju lägre i aktivitetsserien en metall är placerad, desto mindre reaktiv är den däremot. Detta gör att det lättare genomgår en reduktionsreaktion och är därför en starkare oxidant, ett mindre aktivt grundämne. Med hjälp av värdena som visas i tabell 1 kan vi se att ju lägre standardpotentialvärdet för ett grundämne är, desto starkare är reduktionsmedlet och desto mer kemiskt reaktiv är metallen. Ett mått på förmågan att donera elektroner i en rad metallaktiviteter är deras standardpotentialvärde. För väte, eller snarare väteelektroden, antas standardpotentialen vara noll. Standardpotentialen är den elektromotoriska kraften hos en cell som består av en vanlig vätehalvcell och den andra halvcellen där koncentrationerna av substrat och produkter är 1 mol/dm 3 .
| Elektrod | Standardpotential [V] |
| Li/Li + | -3.04 |
| Ca/Ca 2+ | -2,86 |
| Mg/Mg 3+ | -2,36 |
| Al/Al3 + | -1,69 |
| Mn/Mn 2+ | -1.18 |
| Zn/Zn 2+ | -0,76 |
| Cr/Cr 3+ | -0,74 |
| Fe/Fe 2+ | -0,44 |
| Cd/Cd 2+ | -0,40 |
| Co/Co 2+ | -0,28 |
| Ni/Ni 2+ | -0,26 |
| Sn/Sn 2+ | -0,14 |
| Pb/Pb 2+ | -0,14 |
| Fe/Fe 3+ | 0,04 |
| H2 /2H + | 0,00 |
| Bi/Bi 3+ | +0,32 |
| Cu/Cu 2+ | +0,34 |
| Ag/Ag + | +0,80 |
| Hg/Hg 2+ | +0,85 |
| Au/Au 3+ | +1,52 |
Bord 1 . Elektrokemiska serier av metaller De metaller som syns längst upp i serien är de mest aktiva. De ovanför väte tenderar att lätt oxidera och är därför starkare reduktionsmedel än väte. Grundämnen under väte i serien reduceras lättare och är starkare oxidationsmedel. Om en metall har en mer negativ potential än en annan betyder det att den kommer att tränga undan den från sitt salt. Till exempel kommer järn att ersätta koppar i kopparsalter, men koppar kommer inte att ersätta järn från dess salter. Istället kan det ersätta silver från silversalter. Litium och beryllium från lösningar av salter av andra metaller tränger inte undan dem, utan reagerar direkt med vatten. De tränger undan väte och producerar sina föreningar – hydroxider . Sådana metaller kallas aktiva metaller. Metallaktivitet och grundämnenas periodiska system Liksom många andra egenskaper kan ett grundämnes kemiska aktivitet härledas från dess position i det periodiska systemet . De mest aktiva metallerna är de i grupperna I och II, eftersom de lätt tränger undan väte från vatten för att bilda hydroxider. I gruppen ökar den kemiska aktiviteten av metaller med ökande atomnummer . Perioden minskar när atomnumret ökar. 
Ädel- och basmetaller
Väte ger inte bara en referenspunkt för aktivitet, utan separerar också ädelmetaller och basmetaller i serien . Basmetaller är de ovanför väte. Var och en reagerar med syror och ersätter väte från dem. Från kalium till kalcium reagerar de med vatten redan vid rumstemperatur, och från magnesium till järn reagerar de med det vid förhöjda temperaturer. Alla metaller som ligger under väte i aktivitetsserien tränger inte undan väte från syror . De kan dock reagera med oxiderande syror för att bilda motsvarande salter och oxider , som bildas genom att reducera syraresten. Grundämnena i botten av serien, från silver till guld, är så mycket motståndskraftiga mot kemiska reaktioner att de bara reagerar med aqua regia . En sådan lösning är en blandning av en koncentrerad lösning av saltsyra och en koncentrerad lösning av salpetersyra (V) , blandad i ett volymförhållande av 3:1. Genom att känna till dessa fakta kan vi härleda att flera reaktioner kan utföras för att särskilja elementets aktivitet: med vatten vid rumstemperatur, med varmt vatten, med icke-oxiderande syra, med oxiderande syra och med regenvatten.
Experiment för att upptäcka metaller som ersätter väte från syror
Det enklaste sättet att bekräfta metallaktivitet är att utföra ett experiment. För att göra detta bör tio provrör förberedas i vilka följande kommer att placeras successivt: i 1-5: magnesiumband, zinktråd, järntråd, nickeltråd och koppartråd. Samma ordning ska upprepas i rör 6-10. Tillsätt några milliliter saltsyra i rör 1-5 och några milliliter utspädd svavelsyra (VI) till rör 6-10. Applicera en brinnande skena på varje tub. I provrör som innehåller magnesiumband och järn-, zink- och nickeltrådar, översvämmade med syror, avges gasbubblor. Den mest intensiva frisättningen kan observeras i rör som innehåller magnesium. Reaktionerna som sker är följande: 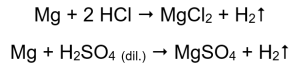 Mängden gas som släpps ut minskar i serien: zink, järn, nickel. Följande reaktioner äger rum i enlighet med detta:
Mängden gas som släpps ut minskar i serien: zink, järn, nickel. Följande reaktioner äger rum i enlighet med detta:  I rör som innehöll koppartrådar syns ingen gas, ingen förändring. Detta betyder att sådana reaktioner inte inträffar:
I rör som innehöll koppartrådar syns ingen gas, ingen förändring. Detta betyder att sådana reaktioner inte inträffar: 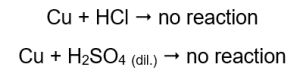 När en brinnande skena appliceras hörs ett distinkt ljud i rören från vilka gasen avges.
När en brinnande skena appliceras hörs ett distinkt ljud i rören från vilka gasen avges.
Sammanfattning av observationer och slutsatser:
Magnesium, zink, järn och nickel reagerar med både saltsyra och svavelsyra (VI). Varje tränger undan väte från syran, vilket gör att de ligger högre upp i metallaktivitetsserien än syran. Reaktionerna ger produkter i form av salter och en gas, väte, som frigörs. Det distinkta ljudet som åtföljde appliceringen av en glödande skena på ett provrör av utströmmande gas orsakas av reaktionen mellan väte och syre. Av alla testade metaller är magnesium den mest reaktiva, följt av zink, järn, nickel och koppar. Vi kan säga eftersom intensiteten på gasbubblorna indikerar metallens aktivitet. Inga förändringar observerades i rör som innehöll koppar. Detta visar att koppar inte kan ersätta väte från vare sig saltsyra eller utspädd svavelsyra (VI).
