Vid kemiska reaktioner observeras fullständig omvandling av substrat till produkter endast för en liten del av dem. De allra flesta, inklusive de som förekommer i vår kropp, är reversibla. För sådana processer upprättas ett tillstånd av kemisk jämvikt. Detta är ett oerhört viktigt begrepp inom kemin, som förknippas med till exempel Le Chateliers princip (eller Jämviktslagen). Kunskap om de grundläggande lagarna och principerna kring kemisk jämvikt gör det till exempel möjligt att förutsäga många reaktioner eller genomföra tekniska processer mer effektivt.
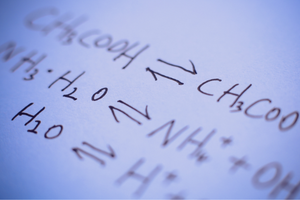
Reversibla och irreversibla reaktioner
Med hänsyn till förloppet av kemiska reaktioner kan en generell uppdelning göras – i reversibla och irreversibla reaktioner. Man bör dock komma ihåg att det i verkligheten inte finns några 100%irreversibla reaktioner, och kvalificeringen till en viss grupp baseras på den rådande slutliga effekten.
Irreversibla reaktioner
I detta fall reagerar substraten i systemet och resulterar i specifika produkter. Det finns dock ingen omvänd transformation – produkter till substrat . I formeln är en enkel pil markerad mellan reaktanterna och pilen pekar mot produkterna. Irreversibla reaktioner är i första hand alla de där fällningar bildas. I praktiken är de olösliga i vatten och kan inte rekonstitueras. Reversibilitet av processen är också svår att uppnå vid reaktioner som sker i öppna system, dvs. i en bägare eller en sfärisk kolv, från vilken en av de resulterande produkterna, t.ex. koldioxid, kan släppa ut fritt, men genom att ändra förhållandena av reaktionen, dvs genom att överföra den till ett slutet system, kan den göras reversibel. I gruppen irreversibla reaktioner ingår också alla processer där interaktionen mellan produktmolekyler sker i mycket mindre utsträckning än mellan substrat. Således sker en sådan process i båda riktningarna, men på grund av att rekonstitutionen av substraten är försumbar klassificeras de i praktiken som irreversibla reaktioner.
Reversibla reaktioner
Det är reaktioner där produkter bildas från substrat och samtidigt sker den omvända processen med jämförbar intensitet – det vill säga rekonstituering av substrat från produkter. I reaktionsformeln placeras två pilar mellan reaktanterna, där pilarna pekar i motsatta riktningar, för att indikera reversibiliteten för de reaktioner som äger rum. Reversibla reaktioner är främst de som utförs i slutna system. Molekyler av substrat och produkter kan inte lämna reaktionsmiljön och de kolliderar med varandra, skapar produkter och rekonstituerar substrat. Ett exempel på en sådan reaktion är produktionen av vätejodid från jod och väte.
Tillståndet för kemisk jämvikt
Huruvida en viss reaktion kan inträffa, eller om den är reversibel eller irreversibel, beror till stor del på de speciella processbetingelserna och typen av processen. Om en reversibel reaktion äger rum, det vill säga substrat förändras till produkter som ett resultat av en kemisk reaktion och samtidigt, som ett resultat av kollisioner av produktmolekyler, genomgår substrat rekreation, då någon gång i tiden då dessa reaktioner inträffar. ett tillstånd av kemisk jämvikt upprättas . Med andra ord är koncentrationerna av substrat och produkter i systemet på en konstant nivå – deras mängd förändras inte trots den kontinuerliga reaktionen. I det kemiska jämviktstillståndet är reaktionshastigheterna i båda riktningarna desamma. Den kemiska jämvikten, under vissa förhållanden, betyder det mest stabila tillståndet för ett visst system. Energibehovet är då mycket lågt. Den kemiska jämviktskonstanten, K , är en koefficient som beskriver jämvikten för två reversibla reaktioner. Den definieras som kvoten av koncentrationerna av produkter och substrat upphöjda till de potenser som motsvarar de stökiometriska koefficienter som mättes i det kemiska jämviktstillståndet. Formeln för konstanten härleddes 1864 som den så kallade lagen om massaktion. Man bör komma ihåg att detta är ett karakteristiskt värde för en viss reaktion. Ett antal faktorer påverkar tillståndet för kemisk jämvikt. Det här är några av dem:
- Temperatur,
- volymen av reaktionssystemet,
- tryck,
- koncentration av reaktanter.
Vad som är viktigt, läget för jämviktstillståndet påverkas inte av tillsatsen eller förändringen av reaktionskatalysatorn. Dess uppgift är bara att förkorta den tid under vilken jämvikt uppnås. 
Le Chateliers princip (jämviktslagen)
Genom att ändra vissa reaktionsförhållanden kan vi påverka dess jämvikt. Systemet kommer alltid att sträva efter att upprätthålla jämvikt, eftersom det är energetiskt gynnsamt för det (lägsta energiförbrukning). Som en konsekvens kommer det att ske förändringar som motverkar de faktorer som får systemet ur balans. Detta fenomen förklarades 1881 och är idag känt som Le Chatelier-Brauns princip eller som jämviktslagen. Det gör det möjligt att förstå systemets svar på förändringar i förhållandena för en reaktion, som är i ett tillstånd av kemisk jämvikt. Tillsatsen av ett av de reagerande ämnena till systemet orsakar en störning av jämvikten. Koncentrationerna av enskilda reaktanter förändras. För att motverka detta tenderar systemet att producera mer produkt (när ett substrat har tillsatts) eller att rekonstituera substratet (när en viss mängd produkt har tillsatts). Att ändra reaktionstemperaturen har en enorm inverkan, särskilt för endotermiska och exoterma processer. I fallet med det förra är det nödvändigt att tillföra energi till systemet i form av värme, så att öka temperaturen i hela processen kommer att förskjuta jämvikten till höger (sänker till vänster), mot bildandet av mer produkt . Motsatsen kommer att vara fallet för exoterma reaktioner, där en av produkterna är värme. Temperaturen har ingen effekt på reaktionens jämvikt, där ingen termisk effekt observeras. När det gäller reaktioner som sker i gasfasen är trycket en mycket viktig aspekt. Att öka värdet på denna parameter, dvs minska systemets reaktionsvolym, kommer att få reaktionsjämvikten att förskjutas. Riktningen av förändringarna beror på de stökiometriska koefficienterna i reaktionsekvationen. Denna parameter kommer inte att påverka den kemiska jämvikten i reaktionen där summan av de stökiometriska koefficienterna för de gasformiga substraten och produkterna är densamma. Det är värt att komma ihåg att när systemet kastas ut ur den kemiska jämvikten kommer jämviktslagen att gälla och som ett resultat kommer ett nytt jämviktstillstånd att uppnås.
