En homogen blandning av minst två ämnen anses vara en lösning. Även om vi främst tänker på en lösning som en flytande, är gasformiga och fasta blandningar också lösningar. Ändå sker en mycket stor grupp av kemiska reaktioner, både i laboratorie- och industriell skala, i en vattenhaltig miljö. Det finns tre typer av flytande lösningar – lösningsmedlet är alltid flytande, men det lösta ämnet kan vara en gas, vätska eller fast. Bland exemplen finns vattenlösningar av väteklorid, etanol och kökssalt.

Beskriv lösningens sammansättning
Den viktigaste egenskapen hos varje lösning är definitionen av dess sammansättning. Förmågan att bestämma sammansättningen av en lösning och att räkna om den beroende på enheterna av intresse är en grundläggande färdighet för varje kemist. Mängden av en given ingrediens i en blandning kan definieras på olika sätt, t.ex. genom massa, volym eller molaritet. Av denna anledning finns det också flera typer av koncentrationer, som definierar beroendet av komponentens mängd på mängden lösning eller blandning. Oftast, när vi beskriver sammansättningen av lösningar, använder vi termerna: massfraktion, volymfraktion, molfraktion och molär koncentration. Bråk anger vilken del av en given blandning som ingrediensen av intresse står för. De kan uttryckas i enheter av massa, volym eller mol av föreningen.
Molar koncentration
Detta är den vanligast valda koncentrationen, på grund av bekvämligheten att använda genom att bestämma antalet mol av ämnet som finns i lösningens volym. Den teoretiska grunden är påståendet att lösningar av två olika ämnen med samma koncentration och volym, vid samma temperatur, innehåller samma antal mol, och därför samma antal molekyler av det lösta ämnet. På basis av detta förhållande är det för lösningar med lika molära koncentrationer möjligt att blanda lämpliga volymer av lösningar för att uppnå den korrekta andelen av antalet mol bestämt av de stökiometriska koefficienterna. Detta betyder att om man tänker på reaktioner av A + B → C-typ, där en mol av ämne A reagerar med en mol av ämne B, måste lika volymer av båda lösningarna med samma molära koncentration blandas för att reaktionen ska fortsätta helt. Vid en reaktion av typ A + 2B → C, dvs en mol ämne A reagerar med två mol ämne B, bör en volym lösning A blandas med två volymer lösning B. I detta fall finns det även en annan lösning, för istället för att använda ekvimolära lösningar i ett volymförhållande på 1:2 kan man använda en volym lösning A och en volym lösning B med två gånger koncentrationen. Molär koncentration, betecknad med C m , definierar antalet mol av ett ämne som finns i en volymenhet, oftast i 1 dm 3 , av en lösning. Formeln som möjliggör beräkning av molkoncentrationen är kvoten av antalet mol av ämnet (n s ) och den totala volymen av lösningen (V sol ) i dm 3 : 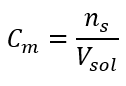 Med basvolymenheten enligt SI-systemet, dvs kubikmeter, bör kilomol användas som enhet för mängden av ämnet. Detta är dock inte ett stort beräkningsproblem, eftersom
Med basvolymenheten enligt SI-systemet, dvs kubikmeter, bör kilomol användas som enhet för mängden av ämnet. Detta är dock inte ett stort beräkningsproblem, eftersom 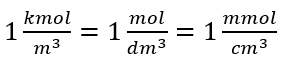 . Enheten för molär koncentration C m definieras som mol per kubikdecimeter, ofta noterad som M. 1 mol/dm 3 = 1M
. Enheten för molär koncentration C m definieras som mol per kubikdecimeter, ofta noterad som M. 1 mol/dm 3 = 1M 
Användningen av molär koncentration
a) Beräkning av molkoncentrationen baserat på innehållet av komponenten i lösningen Exempel 1. Lösningen innehåller 30 g kaliumhydroxid i 3,0 dm 3 av lösningen. Beräkna dess molära koncentration. Steg 1. Beräkning av molmassan av KOH 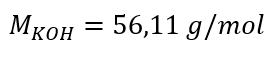 Steg 2. Beräkning av antalet mol KOH i lösningen
Steg 2. Beräkning av antalet mol KOH i lösningen 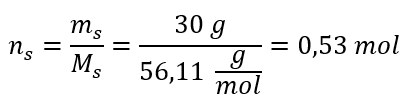 Steg 3. Beräkning av molkoncentrationen med hjälp av formeln
Steg 3. Beräkning av molkoncentrationen med hjälp av formeln 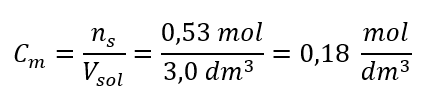 Svar: Molkoncentrationen av en kaliumhydroxidlösning som innehåller 30 g av ämnet i 3,0 dm 3 av lösningen är C m =
Svar: Molkoncentrationen av en kaliumhydroxidlösning som innehåller 30 g av ämnet i 3,0 dm 3 av lösningen är C m = 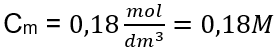 b) Beredning av en lösning med en given koncentration Exempel 2. Beräkna massan av glukos (C 6 H 12 O 6 ) som krävs för framställning av 300 cm 3 av en lösning med en koncentration av 0,32 mol/dm 3 . Steg 1. Beräkning av den molära massan av glukos
b) Beredning av en lösning med en given koncentration Exempel 2. Beräkna massan av glukos (C 6 H 12 O 6 ) som krävs för framställning av 300 cm 3 av en lösning med en koncentration av 0,32 mol/dm 3 . Steg 1. Beräkning av den molära massan av glukos 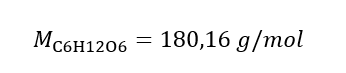 Steg 2. Beräkning av mängden glukos som behövs, med hjälp av den konverterade molarformeln, med vetskap om det
Steg 2. Beräkning av mängden glukos som behövs, med hjälp av den konverterade molarformeln, med vetskap om det 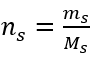 :
: 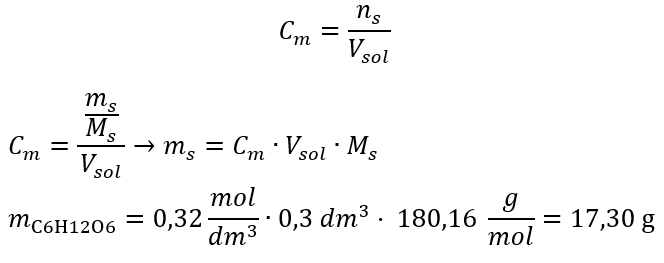 Efter dessa beräkningar vet vi att för att framställa en sådan lösning bör 17,30 g glukos vägas och överföras kvantitativt till en 300 cm 3 mätkolv. Svar: För att bereda 300 cm 3 av en glukoslösning med en molär koncentration av 0,32 mol/dm 3 bör 17,30 g av ämnet vägas upp. c) Spädning och koncentration av koncentrerade lösningar Med hjälp av den molära koncentrationen kan vi också framställa en lösning med en given koncentration (C m2 ) genom att späda den koncentrerade lösningen (C m1 ), där:
Efter dessa beräkningar vet vi att för att framställa en sådan lösning bör 17,30 g glukos vägas och överföras kvantitativt till en 300 cm 3 mätkolv. Svar: För att bereda 300 cm 3 av en glukoslösning med en molär koncentration av 0,32 mol/dm 3 bör 17,30 g av ämnet vägas upp. c) Spädning och koncentration av koncentrerade lösningar Med hjälp av den molära koncentrationen kan vi också framställa en lösning med en given koncentration (C m2 ) genom att späda den koncentrerade lösningen (C m1 ), där: 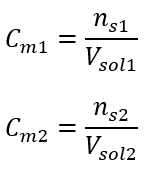 Under utspädning ändras endast volymen av lösningen, antalet mol av det lösta ämnet förblir oförändrat. Så man kan anta att:
Under utspädning ändras endast volymen av lösningen, antalet mol av det lösta ämnet förblir oförändrat. Så man kan anta att: ![]() Genom att transformera formeln för molär koncentration får vi följande samband:
Genom att transformera formeln för molär koncentration får vi följande samband: 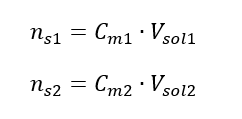 Att veta att vi får ekvationen:
Att veta att vi får ekvationen: 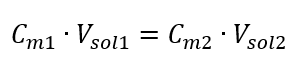 Formeln för utspädning av lösningar, med hänsyn till molär koncentration, inklusive den nyligen erhållna (C mx ) kan noteras som:
Formeln för utspädning av lösningar, med hänsyn till molär koncentration, inklusive den nyligen erhållna (C mx ) kan noteras som: 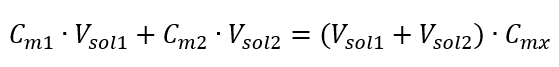 Exempel 3. Vilken volym av 0,150 mol/dm 3 syra kan erhållas genom att späda 250 cm 3 av en 0,750 mol/dm 3 lösning av denna syra med vatten? Steg 1. Transformation av formeln med antagandet att vattenkoncentrationen är C m2 = 0 mol/dm 3 .
Exempel 3. Vilken volym av 0,150 mol/dm 3 syra kan erhållas genom att späda 250 cm 3 av en 0,750 mol/dm 3 lösning av denna syra med vatten? Steg 1. Transformation av formeln med antagandet att vattenkoncentrationen är C m2 = 0 mol/dm 3 . 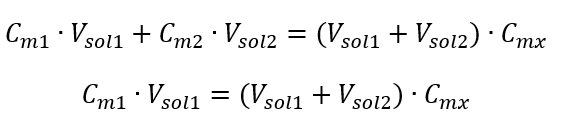 Steg 2. Total volymberäkning (V x )
Steg 2. Total volymberäkning (V x ) 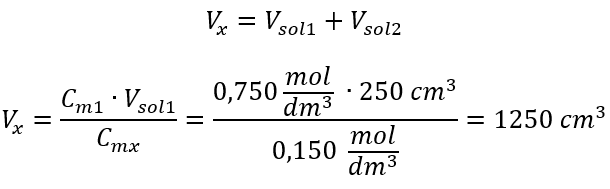 Alternativt kan relationerna mellan beständighet av antalet mol under utspädning användas:
Alternativt kan relationerna mellan beständighet av antalet mol under utspädning användas: 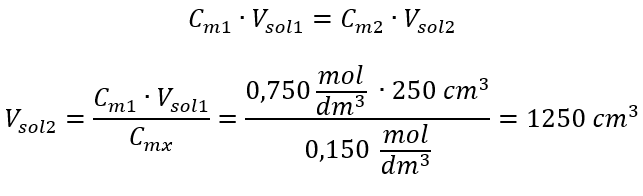 Svar: För att späda ut syran till önskad koncentration måste 1,25 dm 3 vatten användas. Exempel 4. Beräkna hur mycket vatten som måste förångas från 300 cm 3 av en lösning med en koncentration av 0,125 mol/dm 3 för att få en lösning med en koncentration på 1,50 mol/dm 3 . Steg 1. Transformation av formeln för förändringen i molär koncentration med antagandet att den molära koncentrationen av vatten är C m2 = 0 mol/dm 3 .
Svar: För att späda ut syran till önskad koncentration måste 1,25 dm 3 vatten användas. Exempel 4. Beräkna hur mycket vatten som måste förångas från 300 cm 3 av en lösning med en koncentration av 0,125 mol/dm 3 för att få en lösning med en koncentration på 1,50 mol/dm 3 . Steg 1. Transformation av formeln för förändringen i molär koncentration med antagandet att den molära koncentrationen av vatten är C m2 = 0 mol/dm 3 . 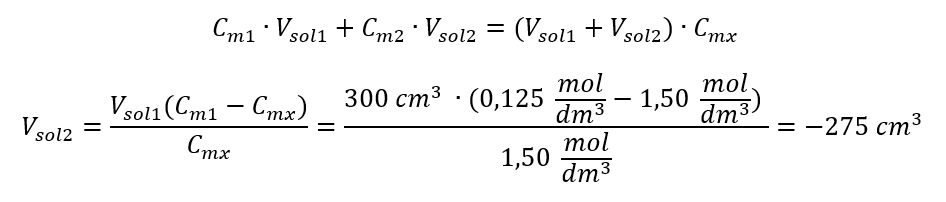 Svar: För att koncentrera lösningen måste 275 förångas. Omvandlingen av molär koncentration vs. procentuell koncentration I det dagliga laboratoriearbetet är det nödvändigt att omvandla olika koncentrationer av lösningar. Oftast används molär koncentration och procentuell koncentration. Det är möjligt att växla mellan dem med hjälp av lösningens densitet. Denna parameter måste införas i formlerna för koncentrationerna av intresse:
Svar: För att koncentrera lösningen måste 275 förångas. Omvandlingen av molär koncentration vs. procentuell koncentration I det dagliga laboratoriearbetet är det nödvändigt att omvandla olika koncentrationer av lösningar. Oftast används molär koncentration och procentuell koncentration. Det är möjligt att växla mellan dem med hjälp av lösningens densitet. Denna parameter måste införas i formlerna för koncentrationerna av intresse: 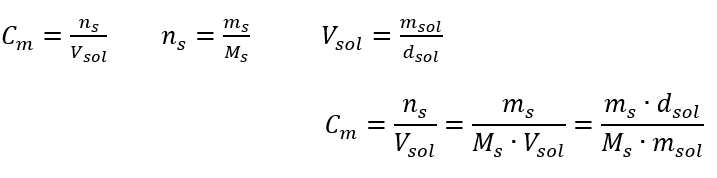 I omvandlingen kan vi se förhållandet mellan ämnets massa och lösningens massa, vilket är grunden för den procentuella koncentrationen, uttryckt med formeln:
I omvandlingen kan vi se förhållandet mellan ämnets massa och lösningens massa, vilket är grunden för den procentuella koncentrationen, uttryckt med formeln: 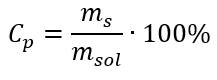 Genom att ersätta formeln för den procentuella koncentrationen med den tidigare transformerade formeln för den molära koncentrationen får vi en relation som tillåter oss att fritt växla mellan de två värdena:
Genom att ersätta formeln för den procentuella koncentrationen med den tidigare transformerade formeln för den molära koncentrationen får vi en relation som tillåter oss att fritt växla mellan de två värdena: 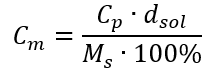 Den enda begränsningen av formeln är användningen av lämpliga enheter, så det är värt att överväga dem i alla beräkningar. Exempel 5. Beräkna den molära koncentrationen av svavelsyra (VI) med vetskap om att dess procentuella koncentration är Cp = 98,0 %och dess densitet är d = 1,84 kg/dm 3 . Detta kan beräknas med två metoder: Metod 1. I några få steg, utan att använda en formel Steg 1. Beräkning av massan av 1,00 dm 3 av syran
Den enda begränsningen av formeln är användningen av lämpliga enheter, så det är värt att överväga dem i alla beräkningar. Exempel 5. Beräkna den molära koncentrationen av svavelsyra (VI) med vetskap om att dess procentuella koncentration är Cp = 98,0 %och dess densitet är d = 1,84 kg/dm 3 . Detta kan beräknas med två metoder: Metod 1. I några få steg, utan att använda en formel Steg 1. Beräkning av massan av 1,00 dm 3 av syran 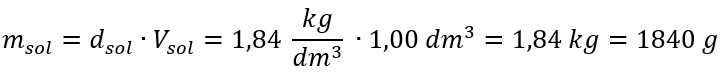 Steg 2. Beräkning av syrans massa med hänsyn till den procentuella koncentrationen
Steg 2. Beräkning av syrans massa med hänsyn till den procentuella koncentrationen 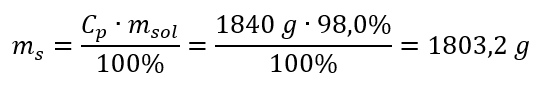 Steg 3. Beräkning av antalet mol
Steg 3. Beräkning av antalet mol 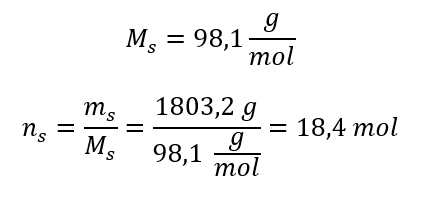 Steg 4. Beräkning av molkoncentrationen med vetskap om att det är antalet mol av ämnet i 1 dm 3 av lösningen
Steg 4. Beräkning av molkoncentrationen med vetskap om att det är antalet mol av ämnet i 1 dm 3 av lösningen 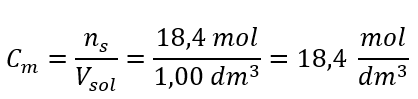 Metod 2. Använda sambandet mellan procentkoncentration och molär koncentration
Metod 2. Använda sambandet mellan procentkoncentration och molär koncentration 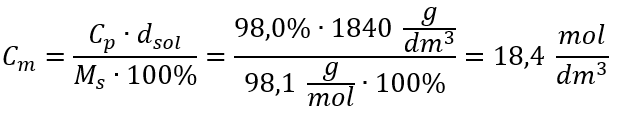 Svar: Molkoncentrationen av denna syra är 18,4 mol/dm 3 .
Svar: Molkoncentrationen av denna syra är 18,4 mol/dm 3 .
