Detta är en grupp oorganiska föreningar som bildas av kombinationen av olika element med syre. Deras allmänna formel är X n O m , där "X" är vilket element som helst, "O" är syre, alltid i det andra oxidationstillståndet, och bokstäverna "n,m" i det nedre indexet är koefficienter. Exempel på oxider: vatten H 2 O, kaliumoxid K 2 O, aluminiumoxid Al 2 O 3 , kalciumoxid CaO och kol(II)monoxid CO.

Klassificering av oxider
Oxider kan delas in i flera kategorier. Den mest allmänna klassificeringen är skillnaden mellan metalloxider, t.ex. litiumoxid, magnesiumoxid, aluminiumoxid, järnoxid och icke-metalloxider, inklusive koloxid, kväveoxid, svaveloxid och kloroxid . Ett annat kriterium är klassificeringen efter deras fysiska tillstånd. Nästan alla metalloxider och vissa icke-metaller (SiO 2 , P 4 O 10 ) är fasta ämnen. Vatten, svavel(VI)oxid och mangan(VII)oxid är vätskor. Icke-metalloxider såsom CO, CO 2 , SO 2 , NO i NO 2 är gaser. Oxider kan också klassificeras efter vilken typ av bindningar som förekommer i dem. Magnesiumoxid MgO, kalciumoxid CaO eller natriumoxid Na 2 O innehåller O 2- joner och jonbindningar, därav deras namn – jonoxider. En annan grupp är kovalenta oxider, t.ex. kol(II)monoxid CO, kväve(II)oxid NO eller svavel(IV)oxid SO 2 , där bindningen mellan syreatomen och grundämnet har formen av en polär kovalent bindning.
Oxiders kemiska karaktär
För kemister är den mest intressanta klassificeringen baserad på oxidernas kemiska natur. Det finns fyra huvudkategorier av oxider – sura, basiska, neutrala och amfotera.
- Sura oxider , ibland även kallade syraanhydrider, kännetecknas av att de reagerar med alkalier med bildning av salt. En betydande del av sura oxider bildar lämpliga lösningar av oxisyror efter upplösning i vatten. Detta gäller t.ex. svavel(IV)oxid, som när den löses i vatten ger svavel(IV)syra , och krom(VI)oxid som löser sig till krom(VI)syra:
SO 2 + H 2 O → H 2 SO 3 CrO 3 + H 2 O → H 2 CrO 4 Det finns en liten grupp sura oxider som är olösliga i vatten. De är dock lösliga i lösningar av starka alkalier, t.ex. kisel ( IV) oxid Si02 , molybden(VI)oxid MoO3 och volfram(VI)oxid WO3 . Deras reaktioner med alkalier bekräftar deras sura karaktär: SiO 2 + 2NaOH → Na 2 SiO 3 + H 2 O MoO 3 + 2KOH → K 2 MoO 4 + H 2 O WO 3 + 2NaOH → Na 2 WO 4 + H 2 O Som en regel, sura oxider är icke-metalloxider och metalloxider vid deras högsta möjliga oxidationstillstånd. Om ett givet grundämne bildar flera oxider vid olika oxidationstillstånd, som till exempel krom, ökar dess oxiders sura egenskaper med ökningen av dess oxidationstillstånd:
- krom (II) CrO-oxid är alkalisk,
- krom(III)oxid Cr 2 O 3 har amfotära egenskaper,
- krom(VI)oxid CrO3 är sur.

- Alkaliska oxider är de föreningar av syre med metaller som reagerar med syror för att ge produkter i form av motsvarande salter. Vissa av dem, dvs oxider av grundämnen från den första och andra gruppen i det periodiska systemet, exklusive beryllium, kännetecknas också av en reaktion med vatten som resulterar i bildning av alkaliska hydroxider. Det inträffar t.ex. under reaktionen av natriumoxid, litiumoxid och bariumoxid med vatten:
Na 2 O + H 2 O → 2NaOH Li 2 O + H 2 O → 2LiOH BaO + H 2 O → Ba(OH) 2 Det finns även alkaliska oxider som inte löser sig i vatten utan bara i sura lösningar. Dessa inkluderar t.ex. mangan(II)oxid och järn(II)oxid: MnO + H 2 SO 4 → MnSO 4 + H 2 O FeO + 2HCl → FeCl 2 + H 2 O
- Neutrala oxider är den minst reaktiva gruppen av oxider. De reagerar inte med vare sig syror eller alkalier. De är också olösliga i vatten. Exempel på denna grupp av oxider är kol(II)monoxid CO och kväve(II)oxid NO.
- Amfotera oxider är raka motsatsen till neutrala oxider och är både sura och alkaliska samtidigt. Det gör att de reagerar med både starka alkalier och syror. Produkterna av dessa reaktioner är alltid salter, och grundämnet som initialt kombineras med syre omvandlas till en lämplig katjon eller anjon av syraresten. Den enda likheten med neutrala oxider är deras dåliga löslighet i vatten. Exempel på amfotära oxider är: berylliumoxid BeO, aluminiumoxid Al 2 O 3 , krom (III) oxid, tenn (II) oxid SnO, bly (II) oxid PbO och zinkoxid ZnO. Genom att reagera med vattenlösningar av starka alkalier, t.ex. med en vattenlösning av natriumhydroxid , bildar de komplexa salter . I sina syrarester finns atomer eller joner av metallen, som härrör från oxiden, i komplex med ett lämpligt antal hydroxylgrupper. Deras antal beror på koordinationsnumret för det givna elementet. Till exempel har atomer som härrör från MO (M – metall)-oxider, såsom berylliumoxid BeO, koordinationsnumret 4. Atomer som härrör från oxider av M 2 O 3 -typ, t.ex. Al 2 O 3 , kan ha två olika koordinationsnummer, och beroende på reaktionsförhållandena är det 4 eller 6. Exempel på reaktioner av amfotära oxider:
BeO + 2HCl → BeCl 2 + H 2 O BeO + 2NaOH + H 2 O → Na 2 [Be (OH) 4] natriumtetrahydroxizinkat Al 2 O 3 + 6 HCl → 2AlCl 3 + 3H 2 O Al 2 O 3 + 2KOH + 3H 2 O → 2K[Al (OH) 4] kaliumtetrahydroxialuminat Al 2 O 3 + 6NaOH + 3H 2 O → 2Na 3 [Al (OH) 6] natriumhexahydroxialuminat Vissa oxider , såsom zinkoxid och mangan(IV)oxid, har ganska specifika amfotära egenskaper. Den senare, varken under normala eller standardförhållanden, reagerar inte med alkalier. Båda reagerar å andra sidan med dem genom att smälta samman med fasta alkalier, t.ex. 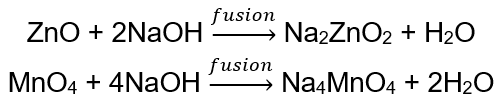

Erhålla oxider
- Direkt syntes av grundämnen: a) syntes av svavelatomer och syreatomer med bildning av svavel(IV)oxid S + O → SO 2 b) syntes av magnesiumatomer och syreatomer med bildning av magnesiumoxid 2Mg + O 2 → 2MgO c) syntes av kolatomer och syreatomer med bildning av kol(IV)monoxid C + O 2 → CO 2
- Termisk nedbrytning av salter , hydroxider och oxider: a) nedbrytning av kalciumkarbonat till kalciumoxid och kol(IV)monoxid CaCO 3 → CaO + CO 2 b) nedbrytning av koppar(II)hydroxid till koppar(II)oxid och vatten Cu( OH) 2 → CuO + H 2 O c) sönderdelning av mangan (IV) oxid till mangan (III) oxid och syre 4MnO 2 → 2Mn 2 O 3 + O 2
- Oxidation av oxider vid lägre oxidationstillstånd, med en ökning av deras valens: a) oxidation av svavel(IV)oxid till svavel(VI)oxid 2SO 2 + O 2 → 2SO 3 b) oxidation av kväve(II)oxid till kväve( IV) oxid 2NO + O 2 → 2NO 2 c) oxidation av kol (II) monoxid till kol (IV) monoxid (IV) 2CO + O 2 → 2CO 2
- Reduktion av oxider vid högre oxidationstillstånd, med en minskning av deras valens: a) reduktion av kol (IV) oxid till kol (II) monooxid (II) CO 2 + C → 2CO b) reduktion av tenn (II) oxid till tenn (I) oxid 2SnO + O2 → 2SnO2
- Förbränning av organiska föreningar: a) förbränning av metan i syre med bildning av kol(IV)monoxid och vatten CH 4 + 2O 2 → CO 2 + 2H 2 O b) förbränning av ammoniak i syre för att erhålla kväve(II)oxid och vatten 4NH3 + 5O2 → 4NO + 6H2O
- Reaktion av instabila oxisyror: a) sönderdelning av kol(IV)syra till kol(IV)monoxid och vatten: H 2 CO 3 → CO 2 + H 2 O b) sönderdelning av svavel(IV)syra till svavel(IV)oxid och vatten: H 2 SO 3 → SO 2 + H 2 O
