pH-skalan används för att bestämma graden av surhet eller alkalinitet för en lösning på en kvantitativ skala som innehåller de absoluta talen från 0 till 14. Den är baserad på den molära aktiviteten hos hydroniumjoner [H 3 O +] i den testade vätskan. Skalan utvecklades 1909 av den danske biokemisten S. Sorensen, och bokstäverna 'p' och 'H' står för det latinska 'potentio' (kraft) respektive väteatomen, som betecknas i det periodiska systemet. som 'H' (väte). pH-skalan speglar både det ena och det andra: för att bestämma pH-nivån använder vi effektexponenten med ett ändrat tecken för att referera till protonerna som innehåller väte. pH-nivån för varje framställd lösning är en av dess viktigaste kemiska egenskaper och en faktor som bestämmer förloppet och hastigheten för många kemiska reaktioner samt typen av de ämnen som produceras.

Differentiering på skalan
pH-skalan inkluderar femton grader, där mittvärdet (7) indikerar ett neutralt pH. Lösningar placerade nära 0 kallas starka syror, medan de på den motsatta sidan, nära 14, kallas starka baser. Ett surt pH betyder att lösningen innehåller för många vätejoner [H 3 O +], och ett basiskt pH betyder att det finns för många hydroxidjoner [OH –]. PH-skalan hänvisas oftast till i samband med lösningar, men den absoluta kemiska potentialen hos en proton gör den tillämpbar i alla aggregationstillstånd. Detta gör att vi direkt kan jämföra alkalinitetsnivån för praktiskt taget vilket ämne som helst.
Självdissociation av vatten
För att till fullo förstå känslan av pH-skalan behöver vi den spontana reaktionen av vattensjälvdissociation, som fortsätter enligt följande ekvation:  Det är en reversibel process vars jämviktskonstant förskjuts till vänster sida av ekvationen, det vill säga mot odissocierat vatten.
Det är en reversibel process vars jämviktskonstant förskjuts till vänster sida av ekvationen, det vill säga mot odissocierat vatten.
Hur beräknar man pH-nivån?
Trots det felaktigt definierade initiala antagandet att bestämningen gäller koncentrationen av vätejoner [H +], är den mest populära formeln fortfarande följande:  Idag vet vi redan att lösningar inte innehåller vattenhaltiga vätejoner, dvs. protoner som finns i vatten, på grund av den omedelbara solvatiseringsprocessen. Fenomenet resulterar i bristen på fria protoner och närvaron av hydroniumjoner [H 3 O +], vilket orsakas av den spontana, irreversibla reaktionen:
Idag vet vi redan att lösningar inte innehåller vattenhaltiga vätejoner, dvs. protoner som finns i vatten, på grund av den omedelbara solvatiseringsprocessen. Fenomenet resulterar i bristen på fria protoner och närvaron av hydroniumjoner [H 3 O +], vilket orsakas av den spontana, irreversibla reaktionen: 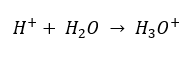 Därför är den korrekta notationen av formeln som följer:
Därför är den korrekta notationen av formeln som följer: 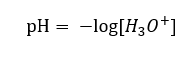
Miljö angiven på pH-skalan
Det antas att koncentrationen av hydroniumjoner i rent vatten vid rumstemperatur (25 o C) är 10 -7 mol/dm 3 , så dess pH-nivå kan beräknas enligt följande: 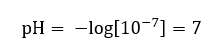 Detta är i linje med det faktum att vatten, eftersom det är neutralt, är placerat i mitten av skalan, vilket indikerar kemisk tröghet hos ämnet. Det bevisar också att vatten innehåller lika många hydroxidanjoner och hydroniumkatjoner. I syror och baser är den jämvikten dock störd. En negativ exponent antyder ett samband där ju lägre pH-nivå, desto högre kraft har den testade lösningen. Termen ‘power’ i pH-skalans sammanhang syftar på att värdet 0 tas av starka, till och med irriterande syror, medan värdet 14 avser de starkaste alkaliska ämnena.
Detta är i linje med det faktum att vatten, eftersom det är neutralt, är placerat i mitten av skalan, vilket indikerar kemisk tröghet hos ämnet. Det bevisar också att vatten innehåller lika många hydroxidanjoner och hydroniumkatjoner. I syror och baser är den jämvikten dock störd. En negativ exponent antyder ett samband där ju lägre pH-nivå, desto högre kraft har den testade lösningen. Termen ‘power’ i pH-skalans sammanhang syftar på att värdet 0 tas av starka, till och med irriterande syror, medan värdet 14 avser de starkaste alkaliska ämnena.
Tillsats av syra i vatten
En förändring av pH från en neutral nivå kan orsakas av tillsats av ämnen med olika krafter. Till exempel, om vi tillsätter en av de starkaste syrorna ( saltsyra, HCl ) till vatten, kommer det att få syran att dissociera enligt följande reaktion:  Till skillnad från vattens självdissociering är jämvikten för syradissociation signifikant förskjuten åt höger. Därför, om denna syra löses i miljömässigt inert vatten, kommer den att öka mängden hydroniumjoner som finns i vattnet och, följaktligen, öka deras molära aktivitet. För att ge ett exempel, enligt dissociationsreaktionen, introducerar saltsyra koncentrerad vid 1 mol/dm 3 till lösningen hydroniumjoner koncentrerade vid 1 mol/dm 3 . pH-nivån för en sådan saltsyralösning kan beräknas utifrån följande formel:
Till skillnad från vattens självdissociering är jämvikten för syradissociation signifikant förskjuten åt höger. Därför, om denna syra löses i miljömässigt inert vatten, kommer den att öka mängden hydroniumjoner som finns i vattnet och, följaktligen, öka deras molära aktivitet. För att ge ett exempel, enligt dissociationsreaktionen, introducerar saltsyra koncentrerad vid 1 mol/dm 3 till lösningen hydroniumjoner koncentrerade vid 1 mol/dm 3 . pH-nivån för en sådan saltsyralösning kan beräknas utifrån följande formel: 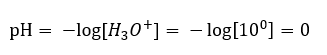
Tillsats av en bas i vatten
I motsatt fall, när vi lägger till en stark bas i vatten, kommer koncentrationen av hydroniumjoner att sjunka. Till exempel kommer natriumhydroxid koncentrerad vid 1mol/dm 3 , analogt, att ha samma koncentration men av andra joner (hydroxidjoner), enligt den reaktion den genomgår under inverkan av vatten:  I ett sådant fall är det möjligt att indirekt beräkna pH med hjälp av följande kompletterande pOH-formel:
I ett sådant fall är det möjligt att indirekt beräkna pH med hjälp av följande kompletterande pOH-formel: 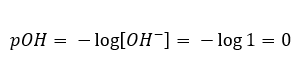 Om vi vet att:
Om vi vet att: 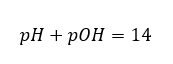 vi kan lätt beräkna att pH-värdet för lösningen av en stark bas (NaOH) koncentrerad till 1 mol/dm 3 har ett pH på 14.
vi kan lätt beräkna att pH-värdet för lösningen av en stark bas (NaOH) koncentrerad till 1 mol/dm 3 har ett pH på 14. 
pH-nivån utanför skalan?
Eftersom pH-skalan ursprungligen utvecklades för utspädda lösningar, är det möjligt att starka syror eller baser överskrider den och går under 0 eller över 14. Detta beror på att skalan är värdelös för höga koncentrationer där pH-värdet inte längre är logaritmiskt. funktion av hydroniumjoner [H 3 O +]. Sedan använder vi olika värden, som uppstår från konstanta jämvikter av dissociationen av syror och baser.
Metoder för att bestämma lösningens pH-värde
För att empiriskt bestämma pH i en miljö använder vi de så kallade syra-basindikatorerna. I praktiken är de ämnen som ändrar färg när de påverkas av olika pH-förhållanden. Det finns tre typer av sådana indikatorer:
- Indikatorer som ändrar färg i en grundläggande miljö, till exempel:
- färglöst fenolftalein blir hallonfärgat,
- färglöst tymolftalein blir blått.
- Indikatorer som ändrar färg i en sur miljö, till exempel:
- metylorange ändrar färg från orange till röd,
- bromtymolblått ändrar färg från blått till gult.
- Universella indikatorer, till exempel:
- bromtymolblått blir gult i syror och blått i baser,
- lacmus blir röd i syror eller blå i baser.
Det är också vanligt att blötlägga lackmuspapper i en blandning av olika indikatorämnen, vilket ökar intervallet för pH-nivåerna. Dessutom använder många laboratorier färdiga, universella lackmuspapper som ändrar färger i intervallet från rött till grönt, vilket på lämpligt sätt föreslår det testade pH-värdet baserat på en medföljande skala. En sådan bestämning gör att vi endast kan uppskatta pH-värdet med en noggrannhet på 0,5 enhet på pH-skalan. En mer exakt metod för att mäta pH-värdet är syra-bastitreringen, som inkluderar undertyperna alkalimetri (titrering med en standardiserad baslösning) och acidimetri (titrering med en standardiserad syralösning). Den använder en titrant med en känd koncentration, som, när den reagerar med det testade ämnet, kontinuerligt varierar koncentrationen av hydroniumjoner i lösningen. Sådan bestämning kan utföras på två sätt: visuellt, vid bestämning av slutpunkten, tillsammans med färgändringen eller med användning av instrumentella metoder, till exempel potentiometri eller konduktometri. Som namnet antyder gör användningen av en pH-mätare också möjligt för oss att definiera ämnets pH-värde. Instrumentet, som fungerar baserat på potentiometri, har en cell i två identiska elektroder. En av dem, kallad indikatorelektroden, ska placeras i den testade lösningen. Den andra (jämförande elektroden) placeras i standardlösningen med ett känt pH-värde. En vanlig substans är silverkloridlösningen. Båda elektroderna är förbundna med en extremt känslig voltmeter, som kontinuerligt omvandlar EMF (elektromotorisk kraft) till ett speciellt resultat i pH-skalan. Enligt Nernst-teorin är cellens elektromotoriska kraft (EMF), bestående av två identiska elektroder nedsänkta i lösningar med olika pH-värden, direkt proportionell mot logaritmen för kvoten av båda koncentrationerna.
Hemmetoder för att mäta pH-värdet
Det visar sig att det finns många naturliga pH-indikatorer , och det ungefärliga pH-värdet kan mätas i hemmiljön. Till exempel blir en infusion gjord av svarta teblad ljusare när den blandas med en syra, t.ex. citronsaft. Omvänt blir det mörkare under påverkan av baser som en lösning av bakpulver. Rödkålsjuice ändrar färg från violett till röd när den utsätts för en syra, eller till blå när den blandas med en bas.
