Det är en av de äldsta instrumentella metoderna som används vid kemisk analys. Dess grunder lades av L. Galvani, CA Volta, JW Gibbs och W. Nernst mellan 1700- och 1800 -talen. Mätningar utförda med potentiometriska metoder använder den elektromotoriska kraften (EMF) från en cell byggd av två elektroder nedsänkta i den testade lösningen. Värdet på den kraften beror direkt på potentialerna hos de använda elektroderna. Dessa beror i sin tur på aktiviteten hos jonerna som finns i elektrolytlösningen och på typen av elektrodprocesser.
Diagram över elektrodprocesser exemplifierat av Daniell-cellen
Daniell-cellen är gjord av två halvceller, som var och en består av en metall nedsänkt i lösningen av sitt eget salt. Komponenthalvcellerna är systemen av Cu (s) /Cu2 + (aq) och Zn (s) /Zn2 + (aq) . Var och en av dem genomgår en av följande redoxreaktioner:
- minskning
Cu 2+ (aq) + 2e – → Cu (s)
- oxidation
Zn (s) → Zn 2+ (aq) + 2e – När vi kombinerar båda reaktionerna får vi den fullständiga ekvationen för reaktionen som sker i cellen: Zn (s) + Cu 2+ (aq) + 2e – → Zn 2 + (aq) + 2e – + Cu (s) För att mäta en viss elektromotorisk kraft i cellen måste vi länka halvcellerna med hjälp av en saltbrygga och ansluta elektroderna till en voltmeter . Således kan vi mäta potentialskillnaden mellan enskilda elektroder, vilket representerar cellens EMF-värde. Enligt IUPAC-konventionen ser diagrammet för Daniell-cellen ut som följer: ϴ Zn|Zn 2+ ||Cu 2+ |Cu ⊕ De enkla linjerna står för gränssnittet, och de dubbla linjerna representerar saltbryggan. Potentialen vid gränsytan är ett resultat av oxidations- och reduktionsreaktionerna. För cellerna antar vi att elektroden där oxidation sker är anoden med ϴ-tecknet, medan den andra är en positiv katod där reduktion sker . Notationen börjar med anoden, och katoden är noterad på höger sida. Den elektromotoriska kraften hos en sådan cell kan beräknas utifrån följande formel: EMF = katodpotential – anodpotential
Standardelektrodpotential
Denna term har introducerats för systematisering, och en bestämd potential för en elektrod anses vara "standard" om den uppfyller några villkor. Mätningen bör utföras vid 298 K, aktiviteten hos aktiva joner måste vara lika med 1 mol/dm 3 och referenselektroden måste vara en vanlig väteelektrod, eftersom det antas att potentialen för den elektroden är 0,0000 V.
Cellens elektromotoriska kraft
EMF-värdet ändras tillsammans med den förändrade aktiviteten hos jonerna som finns i cellen. Ekvationen som återspeglar detta förhållande kallas Nernst-ekvationen : 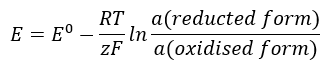 Den använder följande symboler: elektrodpotential (E), standardelektrodpotential (E 0 ), gaskonstant (R) lika med 8,312 J/K·mol, temperatur (T), antalet elektroner involverade i den elektrokemiska reaktionen av elektroner (z), Faraday-konstant (F) lika med 9,64853·10 4 C/mol, och aktiviteten av joner i reducerad och oxiderad form. För fasta ämnen antas aktiviteten (a) vara 1.
Den använder följande symboler: elektrodpotential (E), standardelektrodpotential (E 0 ), gaskonstant (R) lika med 8,312 J/K·mol, temperatur (T), antalet elektroner involverade i den elektrokemiska reaktionen av elektroner (z), Faraday-konstant (F) lika med 9,64853·10 4 C/mol, och aktiviteten av joner i reducerad och oxiderad form. För fasta ämnen antas aktiviteten (a) vara 1. 
Potentiometrisk instrumentering
Grundsatsen för potentiometriska mätningar består av två komponenter: ett par elektroder nedsänkta i den testade lösningen och en mätanordning. Den första komponenten är mätcellen , medan den andra möjliggör den faktiska mätningen av dess elektromotoriska kraft. Den viktigaste delen av en cell är elektroderna. Beroende på deras verkningsmekanism kan de delas in i fyra grupper.
Saltbro
En viktig del av varje cell är saltbryggan, som gör att referenselektroden kan komma i kontakt med den testade lösningen. Det grundläggande kännetecknet för en cell med överföring är kontakten mellan elektrolyter med olika koncentrationer och sammansättningar. För att undvika blandning av bryggans elektrolyt med den testade lösningen används små kontaktytor.
Elektroder av det första slaget
Dessa elektroder är gjorda av en metall eller gas nedsänkt i lösningen som innehåller deras egna joner. De kallas också elektroder som är reversibla till katjonen , eftersom följande reversibla reaktion sker på deras yta: M 0 ↔ M n+ + ne Ett exempel på elektroder av det första slaget är väteelektroden.
Elektroder av det andra slaget
Sådana elektroder är byggda av en metall täckt med dess svårlösliga salt . Systemet är nedsänkt i ett fritt lösligt salt, som innehåller samma anjon som det svårlösliga saltet. Dessa elektroder kallas elektroder som är reversibla till den vanliga anjonen , eftersom följande reaktion sker på deras yta: M 0 + A – ↔ MA + e Exempel på elektroder av det andra slaget inkluderar silver-silverklorid- eller kalomelelektroderna.
Elektroder av det tredje slaget
Dessa består av metaller omgivna av två lager: det första, tunna lagret av ett svårlösligt salt av den metallen, och det andra lagret av ett något bättre lösligt salt som innehåller samma anjon. De är elektroder reversibla till vanlig katjon , eftersom följande reaktion sker på deras yta: M 0 (a) + M (b) A ↔ M (a) A + M + (b) + e 
Redoxelektroder
Strukturen hos sådana elektroder kännetecknas av användningen av en kemiskt inert metall, till exempel platina eller guld, som är nedsänkt i en lösning som innehåller ett ämne i både reducerad och oxiderad form. Ett exempel på sådana elektroder är kinhydronelektroden.
Elektrodernas funktioner i ett system
När det gäller tillämpning i ett analytiskt system särskiljer vi:
- referenselektroder , som upprätthåller en konstant potential oavsett mätförhållanden eller koncentrationen av den testade lösningen.
- indikatorelektroder , vars potential ändras om den testade lösningen innehåller joner, för vilka de är känsliga.
Referenselektroder
Potentiometrisk mätning baseras på en jämförelse av potentialen för indikatorelektroden med referenselektroden. Av denna anledning måste sådana elektroder kännetecknas av:
- stabil potential,
- reproducerbar potential och temperaturoberoende,
- mångsidighet och användarvänlighet,
- lågt elektriskt motstånd,
- reproducerbar och låg diffusionspotential,
- lite flöde av elektrodens elektrolyt till den testade lösningen.
En vanlig referenselektrod är silver-silverkloridelektroden (Ag/AgCl/KCl), som reagerar på närvaron av kloridjoner. Den är byggd av en silvertråd belagd med ett lager av silverklorid. Ett annat exempel är kalomelelektroden (Pt/Hg/Hg 2 Cl 2 /KCl), vars potential också beror på aktiviteten i en kloridjonlösning.
Indikatorelektroder
För elektroderna från denna kategori förändras deras potential i närvaro av testade joner i lösningen. Detta innebär att deras potential direkt beror på aktiviteten, så även koncentrationen, av lösningen där de placeras. De vanligaste är elektroder nedsänkta i lösningar av sina egna joner, såsom silver-, kvicksilver- eller väteelektroder. Men jonselektiva membranelektroder används i modern potentiometri. De har några gemensamma egenskaper, till exempel är deras aktiva del membranet, och jonreaktionen mellan jonerna från lösningen och membranet bestämmer skillnaden i potential vid deras gränssnitt. Sådana elektroder kan delas upp baserat på deras struktur i glas-, fastmembran-, vätskemembran- och dubbelmembranelektroder. De mest använda är glaselektroderna, som är byggda av ett glasrör som avslutas med en tunnväggig glödlampa av elektrodglas. Den rymmer den interna silver-silverkloridelektroden nedsänkt i den inre lösningen med en konstant aktivitet av joner.
