Spektroskopiska metoder är en grupp metoder där signal produceras genom interaktion av elektromagnetisk eller korpuskulär strålning med det undersökta provet. Denna strålning kan uppstå som ett resultat av periodiska förändringar i det elektromagnetiska fältet i samband med energiöverföring. Dessa metoder används för att bestämma koncentrationen eller innehållet av atomer i ett givet absorberande eller emitterande system. Vilka typer av spektrofotometri finns det och vad innebär dessa metoder? Detta är vad du kommer att få reda på från vår artikel.

Strålning och energiövergångar
Den viktigaste egenskapen hos fotoner, eller strålningskvanta, är energi. Formeln för energivärdet (E) är produkten av Plancks konstant (h) på 6,626·10 -34 [J ·s] och strålningsfrekvensen (v) uttryckt i Hertz [Hz]. 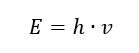 Spektrofotometri använder sig av energiövergångar i molekyler, orsakade av absorption eller emission av elektromagnetisk strålning inom olika områden:
Spektrofotometri använder sig av energiövergångar i molekyler, orsakade av absorption eller emission av elektromagnetisk strålning inom olika områden:
- ultraviolett (UV) 200-380 nm,
- synlig strålning (Vis) 380-780 nm,
- nära infraröd (IR) 0,78-30000 μm.
Grundläggande begrepp och lagar för spektrofotometri
Isobetisk punkt
Detta är den punkt som motsvarar en specifik våglängd som är ett resultat av skärningspunkten av kurvor plottade i absorbans-våglängdssystemet, där båda formerna av föreningen i lösning (dissocierad och odissocierad) har lika stor absorption. En förändring i pH ändrar inte positionen, en förening kan ha många sådana punkter.
Absorptionsspektrum för en kemisk förening
Spektrum är ett mått på mängden ljus som absorberas av föreningen från ljusvåglängden (λ). Om elektromagnetisk strålning (ljus) med intensitet I 0 faller på ett prov kommer en del av denna strålning att absorberas och en del kommer att passera genom provet. Genom att registrera intensiteterna av infallande (I 0 ) och transmitterad (I t ) strålning kan vi bestämma mängden ljus som absorberas av lösningen (absorbans, A), eller som har passerat genom den (transmittans, T).
Absorbans
Den kvantitet som beskriver fenomenet absorption är absorbans. Detta är ett dimensionslöst mått på intensiteten av elektromagnetisk strålning i förhållande till antalet fria atomer. Denna siffra infördes för att underlätta beräkningar relaterade till absorptionsvolymer. Absorption är interaktionen mellan elektromagnetisk strålning och materia – absorptionen av en del av energin av materia. Absorbans är additiv och kallas ibland för optisk densitet. Symboliskt registreras det som Abs eller A. Matematiskt är det decimallogaritmen för förhållandet mellan intensiteten hos strålen av strålning som infaller på testprovet (I 0 ) och intensiteten hos strålen av strålning som sänds genom testprovet ( Den ). Det kan ta värden från 0 till oändligt. Det matematiska uttrycket som beskriver detta förhållande kallas Beer-Lambert-lag. Absorbansen vid en given våglängd beror på absorptionskoefficienten (ε), tjockleken på det absorberande skiktet (vanligtvis 1 cm) och koncentrationen av testlösningen.
Transmittans
Transmittans är förhållandet mellan irradiansen som passerar genom provet (I t ) och irradiansen som infaller på provet (I 0 ), vilket är lika med irradiansen som passerar genom referensen. Det uttrycks oftast i procent och kan variera från 0 %till 100 %. Det uttrycks med formeln: 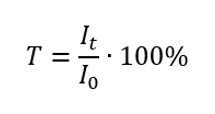 Förhållandet mellan absorbans och transmittans uttrycks enligt följande:
Förhållandet mellan absorbans och transmittans uttrycks enligt följande: 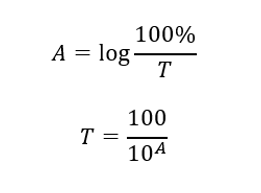
Lambert Law
Det står att absorbansen är proportionell mot tjockleken på det absorberande skiktet i ett homogent prov. Det kan registreras som kvoten av absorptionskoefficienten (k) och tjockleken på det uppmätta provlagret (l): 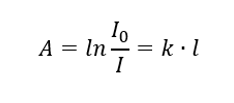

Beer-Lambert lag
Det gäller absorption av strålning av lösningar och kan formuleras enligt följande: om lösningsmedlets absorptionskoefficient är noll, är absorbansen av en monokromatisk strålstråle som passerar genom en homogen lösning direkt proportionell mot lösningens koncentration (c) och till tjockleken på det absorberande skiktet (l). Beer-Lamberts lag är definitionen av absorbans och kan skrivas på följande sätt: 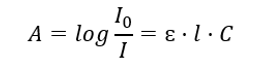 Den molära absorptionskoefficienten (ɛ) är ett karakteristiskt värde för ett ämne i ett visst lösningsmedel och vid en viss våglängd. Den är proportionell mot sannolikheten för övergångar mellan molekylens energinivåer och beror direkt på strålningsfotonernas energi. I numeriska termer representerar det absorbansen som uppvisas av en lösning med en koncentration av 1 mol/dm 3 , med en absorberande skikttjocklek på 1 cm. Att känna till koefficienten gör det möjligt att bestämma koncentrationen av testlösningen efter mätning av absorbansens storlek. Eventuellt kan lösningens förväntade absorbans också beräknas från koefficienten och koncentrationen. Formeln används främst för att bestämma koncentrationen av ett ämne med en känd molär absorptionskoefficient och empiriskt uppmätt absorbans. Detta kan göras med hjälp av en formel eller genom att rita en kalibreringskurva för ämnet vid flera punkter i intervallet för förväntad koncentration. Beer-Lamberts lag kan också presenteras som koncentrationsberoende av absorption: A = f(C).
Den molära absorptionskoefficienten (ɛ) är ett karakteristiskt värde för ett ämne i ett visst lösningsmedel och vid en viss våglängd. Den är proportionell mot sannolikheten för övergångar mellan molekylens energinivåer och beror direkt på strålningsfotonernas energi. I numeriska termer representerar det absorbansen som uppvisas av en lösning med en koncentration av 1 mol/dm 3 , med en absorberande skikttjocklek på 1 cm. Att känna till koefficienten gör det möjligt att bestämma koncentrationen av testlösningen efter mätning av absorbansens storlek. Eventuellt kan lösningens förväntade absorbans också beräknas från koefficienten och koncentrationen. Formeln används främst för att bestämma koncentrationen av ett ämne med en känd molär absorptionskoefficient och empiriskt uppmätt absorbans. Detta kan göras med hjälp av en formel eller genom att rita en kalibreringskurva för ämnet vid flera punkter i intervallet för förväntad koncentration. Beer-Lamberts lag kan också presenteras som koncentrationsberoende av absorption: A = f(C).
Additivitetens lag
Beer-Lamberts lag hänvisar till fallet där det finns ett absorberande ämne i lösning. Men om det finns fler ämnen i en flerkomponentlösning som absorberar strålning vid en vald våglängd, är absorbansen för denna lösning (A) lika med summan av absorbanserna för dess individuella komponenter (A 1 , A 2 ,…), dvs. A= Ai + A2 +⋯+A n . Det är värt att notera och komma ihåg att absorbansen för varje komponent är produkten av dess koncentration och motsvarande molära absorptionskoefficient. Detta är den tredje absorptionslagen, som används i spektrofotometrisk analys av flerkomponentsystem.
Avvikelser från absorptionens lagar
En förutsättning för att uppfylla absorptionslagarna är att strålningen som verkar på systemet är monokromatisk och att dess intensitet inte är för hög. Skälen för att avvika från Beer-Lamberts lag kan vara:
- ofullkomlighet hos mätinstrument, vilket resulterar i att villkoret inte uppfylls,
- kemiska reaktioner som inträffar under mätningen, till exempel polymerisation , hydrolys, kondensation,
- lösningens grumlighet.
Tillämpning av elektronabsorptionsspektra
- Det gör det möjligt att bestämma typen av elektronövergångar genom att undersöka spektra i lösningsmedel med olika polaritet.
- Skillnaderna i positionen och intensiteten av absorptionsbanden för de olika molekylformerna används för att studera jämvikten mellan dem i lösningen ( strukturstudier , tautomera jämvikter).
- Används för sammansättningsbestämning baserad på Beer-Lamber-lag.
- Används som en ytterligare identifieringsmetod baserad på λ max- positionen för testämnen.
- Används vid bestämning av renheten hos testföreningar – förskjutning av absorptionsmaximumpositionen, jämförande av förhållandet mellan absorbansvärden vid två olika punkter i spektrumet.

UV-Vis elektronspektroskopi
När det gäller fenomenet absorption är UV-Vis-spektrofotometri en särskilt intressant teknik som möjliggör kvalitativ och kvantitativ analys av många ämnen. Strålningsabsorptionsfenomenet används när: absorptionen beror linjärt på koncentrationen eller när absorptionen är additiv, dvs för en flerkomponentlösning är det summan av absorptionerna av dess komponenter. Villkoren är uppfyllda när det inte finns några intermolekylära interaktioner i systemet. Genom att analysera UV-Vis-absorptionsspektra som härrör från passagen av elektromagnetisk strålning genom lösningen, observeras övergångar av valenselektroner från marken till det exciterade tillståndet. Detta fenomen resulterar i att en del av strålningen absorberas vid vissa våglängder. Absorption är konsekvensen av övergången av dessa elektroner till högre energinivåer, men för att detta ska ske måste mängden elektromagnetisk strålning ha tillräckligt med energi för att balansera energiskillnaden mellan energinivåerna. I molekyler är sådana energier några få elektronvolt, vilket exakt motsvarar UV-Vis-frekvensen.
Kromoforer
Föreningar som uppvisar absorption i UV-Vis-området har kromoforer i sin struktur, dvs grupper av atomer vars elektroner kännetecknas av låga excitationsenergier. Med andra ord är en kromofor den del av en molekyl (atomgrupp) som ansvarar för den selektiva absorptionen av strålning i det synliga området (180-800 nm) och därmed för uppkomsten av färg. Dessa inkluderar: aromatiska ringar (aromatiska elektronsextett), multipelbindningar (en del av dem – bindningar av π-typ), både mellan kolatomer och andra, såsom karbonylgruppen C=O.
Auxokromer
En annan grupp av atomer är auxokromer, dvs substituenter som inte uppvisar absorption i UV-Vis-området, men deras närvaro orsakar förändringar i de absorberande elementens spektra. De förstärker kromoforernas verkan, vilket vi ofta kan observera i form av en mycket mer intensiv färgning av testsubstansen än vid frånvaro i systemet. Dessutom delar vi in auxokromerna i batokromer t.ex. –NH 2 , -OH, som förskjuter absorptionsmaximum mot längre våglängder, och hypsokromer , såsom –CH 3 , -CO, som förskjuter maximum mot kortare våglängder.
Atomabsorptionsspektroskopi (AAS)
Detta är en annan teknik som använder fenomenet absorption. Det används för att bestämma kemiska element i form av prover i vilket tillstånd som helst (vätska, fast, gas) och själva mätningen är baserad på att observera absorptionen av strålning av en specifik våglängd av fria metallatomer. Grunden för tekniken är att en atom endast kan absorbera elektromagnetisk strålning vid en våglängd vid vilken den också kan sända ut den, och detta är endast karakteristiskt för det givna grundämnet. Med högre energi som tillförs atomen exciteras elektronerna till högre nivåer och ett större antal linjer observeras i spektrumet. Om den tillförda energin motsvarar atomens joniseringspotential, bildas joner som Na + . Grunden för kvantitativ analys med atomabsorptionsspektrometri är absorbansens proportionalitet mot antalet absorberande atomer och Beer-Lamberts lag.
