Stökiometri är den gren av allmän kemi som sysslar med beräkningar rörande det kvantitativa förloppet av kemiska reaktioner. När man arbetar i laboratoriet är det mycket ofta nödvändigt att veta hur mycket (massa, volym, molekyler) av substraten vi behöver använda för att den kemiska reaktionen vi genomför ska äga rum helt eller för att få fram mängden produkt Vi vill. Ibland är det också nödvändigt att beräkna överskott eller bristande substrat som gjorde att experimentet gick annorlunda än förväntat. Var och en av dessa beräkningar följer direkt från den kvantitativa tolkningen av den kemiska reaktionsekvationen och använder lagarna för bevarande av massa. Dessa typer av ekvationer kallas stökiometriska beräkningar.

Vad behöver vi veta?
För att kunna använda stökiometri behöver vi ha kunskap inom ett antal områden, inklusive: kemiska reaktionsekvationer, stökiometriska koefficienter, mol och molära massor och molära volymer av gaser och Avogadros lag. Med hjälp av kunskap om stökiometri av kemiska reaktioner kan många beräkningsproblem lösas, såsom:
- elementaranalys,
- molar beräkningar,
- massberäkningar,
- beräkning av icke-stökiometriska blandningar med möjlighet att bestämma det begränsande ämnet i reaktionen,
- reaktionsutbyte.
Molar massa
På grund av den ofattbart lilla massan av enskilda atomer och molekyler skapades enheten (u) , som uttrycker atommassa. I praktiken är detta ett värde lika med 1/12 av massan av kolisotopen 12 C. Denna del av ett ämne är nära besläktad med Avogadros konstant och bestäms som antalet gram av ett ämne som innehåller 6,022·10 23 atomer, molekyler eller joner. Molmassan [M] är numeriskt lika med atom- eller molekylmassan och enheten är g/mol.
Molar volym av ämne [Vm]
Detta är ett ämnesspecifikt värde som starkt beror på temperatur- och tryckförhållanden. Detta är volymen av ämnet som upptas av en mol av det. Under normala förhållanden antas ett konstant värde på 22,4 dm 3 .
Lagen om konstant sammansättning och bevarande av massa
Varje kemisk förening, oavsett ursprung och metod för att erhålla den, har en väldefinierad och konstant kvalitativ och kvantitativ sammansättning. Svavel(IV)oxid innehåller till exempel alltid 50 viktprocent svavel och svavel(VI)oxid 40 viktprocent av detta grundämne. I ett slutet system är massan av de resulterande produkterna lika med massan av substraten som förbrukas under reaktionen. Lagen om bevarande av massa återspeglas i behovet av att balansera varje kemisk reaktionsekvation med lämpliga kemiska koefficienter så att de två sidorna av ekvationen är lika med avseende på antalet närvarande atomer. Stökiometriska förhållanden återspeglar molförhållandena för reaktanterna närvarande i den kemiska reaktionen.
Kemisk reaktionsekvation
All information som behövs om de relativa förhållandena mellan kemiska ämnen kommer från deras kemiska reaktionsekvation. Det ger en del viktig relativ och kvantitativ information.
Exempel 1.
Från ekvationen för syntesen av ammoniak , som följer reaktionen: ![]() vi kan utföra flera tolkningar – molekylära, molära, molära massor, molära volymer och molekylära tal. a) Molekylärt kan vi läsa att tre vätemolekyler reagerar med en molekyl kväve och bildar två molekyler ammoniak. b) Detta betyder också att tre mol väte reagerar med en mol kväve för att bilda produkten av två mol ammoniak. c) Med hjälp av det periodiska systemet för kemiska grundämnen , som innehåller molmassorna för de enskilda atomerna, kan vi också dra slutsatsen från ekvationen att 6 g väte har reagerat fullständigt med 28 g kväve för att bilda 34 g ammoniak. d) Sedan, om vi antar normala förhållanden, vet vi att en mol gas upptar 22,4 dm 3 . Detta gör att vi kan dra slutsatsen att 67,2 dm 3 väte reagerar med 22,4 dm 3 kväve för att bilda 44,8 dm 3 ammoniak. e) Ett annat användbart samband är Avogadros lag, som säger att lika volymer av olika gaser innehåller samma antal partiklar under samma tryck- och temperaturförhållanden. Genom att känna till Avogadros konstant på 6,022·10 23 vet vi att vi behöver 3·6,022·10 23 vätemolekyler och 6,022·10 23 kvävemolekyler för att utföra den fullständiga kemiska reaktionen för syntesen av ammoniak. Reaktionen ger 2·6,022· 1023 ammoniakmolekyler.
vi kan utföra flera tolkningar – molekylära, molära, molära massor, molära volymer och molekylära tal. a) Molekylärt kan vi läsa att tre vätemolekyler reagerar med en molekyl kväve och bildar två molekyler ammoniak. b) Detta betyder också att tre mol väte reagerar med en mol kväve för att bilda produkten av två mol ammoniak. c) Med hjälp av det periodiska systemet för kemiska grundämnen , som innehåller molmassorna för de enskilda atomerna, kan vi också dra slutsatsen från ekvationen att 6 g väte har reagerat fullständigt med 28 g kväve för att bilda 34 g ammoniak. d) Sedan, om vi antar normala förhållanden, vet vi att en mol gas upptar 22,4 dm 3 . Detta gör att vi kan dra slutsatsen att 67,2 dm 3 väte reagerar med 22,4 dm 3 kväve för att bilda 44,8 dm 3 ammoniak. e) Ett annat användbart samband är Avogadros lag, som säger att lika volymer av olika gaser innehåller samma antal partiklar under samma tryck- och temperaturförhållanden. Genom att känna till Avogadros konstant på 6,022·10 23 vet vi att vi behöver 3·6,022·10 23 vätemolekyler och 6,022·10 23 kvävemolekyler för att utföra den fullständiga kemiska reaktionen för syntesen av ammoniak. Reaktionen ger 2·6,022· 1023 ammoniakmolekyler.
Exempel 2.
Förbränningsreaktionen av magnesium i klor som sker enligt ekvationen: ![]() låter oss komma med tolkningar som liknar det tidigare exemplet. a) Redan vid första anblicken tillåter den presenterade ekvationen oss att dra slutsatsen att, för att erhålla en molekyl magnesiumklorid , måste vi tillhandahålla en molekyl magnesium och en molekyl klor som substrat. b) Detta motsvarar naturligtvis antalet mol som finns i systemet, dvs en mol magnesium, en mol klor, en mol magnesiumklorid. c) För massberäkningar vet vi att 24 g magnesium reagerar med 71 g klor och bildar 95 g magnesiumklorid. d) Eftersom endast en gas, klor , är involverad i den kemiska reaktionen i fråga, kan vi också skriva för den att den upptar en volym av 22,4 dm 3 . e) I partikelantal är varje komponent lika med den andra och tar värdet 6,022·10 23 .
låter oss komma med tolkningar som liknar det tidigare exemplet. a) Redan vid första anblicken tillåter den presenterade ekvationen oss att dra slutsatsen att, för att erhålla en molekyl magnesiumklorid , måste vi tillhandahålla en molekyl magnesium och en molekyl klor som substrat. b) Detta motsvarar naturligtvis antalet mol som finns i systemet, dvs en mol magnesium, en mol klor, en mol magnesiumklorid. c) För massberäkningar vet vi att 24 g magnesium reagerar med 71 g klor och bildar 95 g magnesiumklorid. d) Eftersom endast en gas, klor , är involverad i den kemiska reaktionen i fråga, kan vi också skriva för den att den upptar en volym av 22,4 dm 3 . e) I partikelantal är varje komponent lika med den andra och tar värdet 6,022·10 23 . 
Procentandel av kemisk reaktion [ %W]
Stökiometriska beräkningar används också för att ta reda på utbytet av en reaktion, dvs förhållandet mellan den faktiska mängden produkt som erhålls och mängden som härrör från den kemiska reaktionsekvationen.
Exempel 1.
Oxidationsreaktionen av 30 kg svavel(IV)oxid utfördes och i närvaro av en platinakatalysator var den erhållna produkten 34 kg svavel(VI)oxid. Med var avkastningen av denna process? Kemisk reaktionsekvation: ![]() Från den registrerade reaktionen kan vi se att två mol svavel(IV)oxid producerar samma mängd mol svavel(VI)oxid. Genom att känna till reaktanternas molära massor vet vi att stökiometriskt, om man antar 100 %utbyte, producerar 128 g SO 2 160 g SO 3 . Med denna kunskap kan vi ordna förhållandet: 0,128 kg SO 2 – 0,160 kg SO 3 30 kg SO 2 – x kg SO 3 Här kommer vi att ta reda på mängden svavel(VI)oxid som skulle produceras vid 100 procent avkastning.
Från den registrerade reaktionen kan vi se att två mol svavel(IV)oxid producerar samma mängd mol svavel(VI)oxid. Genom att känna till reaktanternas molära massor vet vi att stökiometriskt, om man antar 100 %utbyte, producerar 128 g SO 2 160 g SO 3 . Med denna kunskap kan vi ordna förhållandet: 0,128 kg SO 2 – 0,160 kg SO 3 30 kg SO 2 – x kg SO 3 Här kommer vi att ta reda på mängden svavel(VI)oxid som skulle produceras vid 100 procent avkastning. 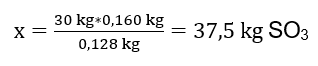 Genom att känna till den teoretiska och faktiska mängden SO 3 kan vi beräkna det utbyte vid vilket reaktionen inträffade. 37,5 kg SO 3 – 100 %utbyte 34 kg SO 3 – x %utbyte
Genom att känna till den teoretiska och faktiska mängden SO 3 kan vi beräkna det utbyte vid vilket reaktionen inträffade. 37,5 kg SO 3 – 100 %utbyte 34 kg SO 3 – x %utbyte 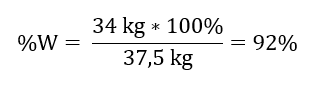 Oxidationen av svavel(IV)oxid till svavel(VI)oxid med användning av en platinakatalysator skedde med 92 %utbyte.
Oxidationen av svavel(IV)oxid till svavel(VI)oxid med användning av en platinakatalysator skedde med 92 %utbyte.
Molekylära och elementära formler
En annan tillämpning av stökiometriska beräkningar är att bestämma formlerna för enkla kemiska föreningar. Molekylformeln för en kemisk förening är identisk med, eller en heltalsmultipel av, den empiriska formeln. Om vi vet att den allmänna formeln för en kemisk förening är N x O y , kan värdena för de stökiometriska indexen beräknas genom att dividera massan per atom med deras atommassor. Om molekylvikten för en kemisk förening inte är känd, utan endast dess procentuella sammansättning, kan endast elementarformeln anges. Det kan vara en sann representation av molekylformeln eller bara bestämma förhållandet mellan de enskilda elementen.
Exempel 1.
Molekylvikten för den kemiska föreningen är 92 u och den består av 30,43 %kväve och 69,57 %syre. Vad är molekylformeln för den kemiska föreningen? Eftersom summan av molekylerna som finns i föreningen är 100 %kan vi anta att: 92 u – 100 %Detta gör det möjligt för oss att beräkna de individuella elementära innehållen: 92 u – 100 %xu kväve – 30,43 %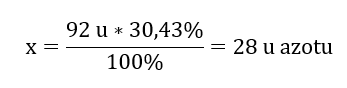 Därför vet vi att massan per syreatom är: 92 u – 28 u = 64 u Genom att känna till de individuella massorna av elementen kan vi bestämma de stökiometriska indexen:
Därför vet vi att massan per syreatom är: 92 u – 28 u = 64 u Genom att känna till de individuella massorna av elementen kan vi bestämma de stökiometriska indexen: 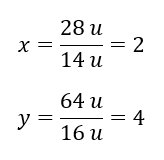 Molekylformeln för denna kemiska förening är N 2 O 4 .
Molekylformeln för denna kemiska förening är N 2 O 4 .
Exempel 2.
Det finns två grundämnen i den kemiska föreningen – syre med 60 %och 40 %svavel. Vad är dess elementära formel? Den allmänna formeln är S x O y , där x är 40 %och y är 60 %. Genom att känna till de enskilda elementens molära massor kan detta representeras enligt följande: 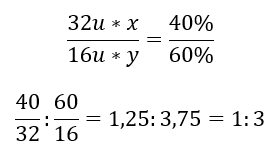 Det betyder att det i den givna kemiska föreningen finns tre syreatomer för varje svavelatom. Grundformeln är SO 3 .
Det betyder att det i den givna kemiska föreningen finns tre syreatomer för varje svavelatom. Grundformeln är SO 3 . 
Överskott och begränsande substrat
I fallet med reaktioner där reaktanterna är närvarande i förhållanden som avviker från deras motsvarande stökiometri, kommer en av reaktanterna att reagera fullständigt och reaktionen avbryts. Den är då närvarande i form av den begränsande reaktanten, medan den andra reaktanten kommer att finnas i systemet i överskott och kommer också fortfarande att finnas i systemet i dess primära form när reaktionen är avslutad.
Exempel 1.
I laboratoriet reagerades 40 cm 3 av en 0,25 M aluminiumsulfatlösning med 50 cm 3 av en 0,5 M bariumkloridlösning. Hur många gram fällning kommer att bildas? Kemisk reaktionsekvation: ![]() Det första steget för att veta det faktiska förloppet av en reaktion är att bestämma det faktiska antalet mol av de ämnen som är involverade i reaktionen. n Al2(SO4)2 : C Al2(SO4)2 · V Al2(SO4)2 = 0,25 · 0,04 dm 3 = 0,010 mol n BaCl2 : C BaCl2 · V BaCl2 = 0,5 · 0,05 dm 3 = 0,025 mol Det andra steget är för att bestämma underskottssubstratet baserat på reaktionens stökiometri – detta kommer att bestämma mängden fällning som bildas. 1mol Al 2 (SO 4 ) 3 – 3 mol BaCl 2 0,010 mol Al 2 (SO 4 ) 3 – x mol BaCl 2
Det första steget för att veta det faktiska förloppet av en reaktion är att bestämma det faktiska antalet mol av de ämnen som är involverade i reaktionen. n Al2(SO4)2 : C Al2(SO4)2 · V Al2(SO4)2 = 0,25 · 0,04 dm 3 = 0,010 mol n BaCl2 : C BaCl2 · V BaCl2 = 0,5 · 0,05 dm 3 = 0,025 mol Det andra steget är för att bestämma underskottssubstratet baserat på reaktionens stökiometri – detta kommer att bestämma mängden fällning som bildas. 1mol Al 2 (SO 4 ) 3 – 3 mol BaCl 2 0,010 mol Al 2 (SO 4 ) 3 – x mol BaCl 2 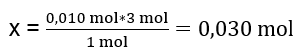 För att utföra reaktionen fullständigt, med 0,010 mol Al 2 (SO 4 ) 3 , är det nödvändigt att tillsätta 0,030 mol BaCl 2 till systemet. Men bara 0,025 mol bariumklorid reagerar, vilket betyder att det är i underskott och kommer att begränsa reaktionen. Därför bör mängden fällning som bildas i reaktionen beräknas från mängden av detta substrat. Antalet mol bariumklorid som används enligt reaktionens stökiometri är lika med antalet mol av den bildade fällningen, alltså: n BaSO4 = n BaCl2 0,025mol BaSO 4 = 0,025mol BaCl 2 Att känna till antalet mol barium sulfat kan vi beräkna dess massa: m BaSO4 = n BaSO4 · M BaSO4 m BaSO4 = 0,025mol · 233,393 g/mol = 5,835g De reaktioner och mängder substrat som ges i uppgiften ger 5,835g bariumsulfatfällning.
För att utföra reaktionen fullständigt, med 0,010 mol Al 2 (SO 4 ) 3 , är det nödvändigt att tillsätta 0,030 mol BaCl 2 till systemet. Men bara 0,025 mol bariumklorid reagerar, vilket betyder att det är i underskott och kommer att begränsa reaktionen. Därför bör mängden fällning som bildas i reaktionen beräknas från mängden av detta substrat. Antalet mol bariumklorid som används enligt reaktionens stökiometri är lika med antalet mol av den bildade fällningen, alltså: n BaSO4 = n BaCl2 0,025mol BaSO 4 = 0,025mol BaCl 2 Att känna till antalet mol barium sulfat kan vi beräkna dess massa: m BaSO4 = n BaSO4 · M BaSO4 m BaSO4 = 0,025mol · 233,393 g/mol = 5,835g De reaktioner och mängder substrat som ges i uppgiften ger 5,835g bariumsulfatfällning.
