Elektronegativitet är en kvantitet som återspeglar tendensen hos en given atom i en molekyl att attrahera elektroner mot sig själv. I praktiken är det förmågan hos en atom eller funktionella grupper att attrahera elektrontäthet. Den mest använda skalan förknippad med denna kvantitet är den som introducerades av Linus Pauling, vilket gör det möjligt att enkelt beräkna bindningens ungefärliga karaktär.

Elektronegativitetsegenskaper
Homonukleära molekyler, till exempel H 2 och O 2 , har lika koefficienter c A och c B i sina molekylära orbitaler, vilket kan registreras som vågfunktioner: Ψ +AB = c A Ψ A + c B Ψ B Ψ −AB = c A Ψ A − c B Ψ B I det här fallet kännetecknas orbitalen av att dess form är symmetrisk med avseende på molekylens centrum, och dess elektriska laddning är lika symmetriskt fördelad inom den. Ett annat exempel är dock heteronukleära molekyler, där det är praktiskt taget omöjligt att upprätthålla lika koefficienter, samt full symmetri med avseende på molekylens centrum. När energinivån för atomomloppsbanan Ψ B är lägre än energinivån för atomomloppsbanan Ψ A , uppstår sambandet, och maximum av elektronsannolikhetstätheten förskjuts mot atom B. I praktiken resulterar detta i en förskjutning av elektronen par i den kemiska bindningen, dvs polarisering mot atom B. Till exempel i litiumhydridmolekylen LiH är denna förskjutning mot väteatomen, medan den i vätefluoridmolekylen HF är mot fluoratomen. Det betyder att väteatomen har en lägre energinivå än litium, men en högre energinivå än fluor (läs om halogener ). Under dessa förhållanden tar en av atomerna i båda molekylerna en negativ laddning betecknad som -δ och den andra är positiv +δ. Den allmänna formeln för en sådan molekyl är A +δB -δ .
Laddningar av atomer
Den tidigare nämnda laddningen δ kan anta olika värden beroende på de grundämnen som är bundna av den kemiska bindningen . Dess värde 0 betyder att laddningen av elektronparet fördelas symmetriskt och paret ligger helt i närheten av atomen med en lägre energinivå, vilket resulterar i att båda elektronerna överförs till den atomen. Detta skapar en jonbindning mellan elementen. I de allra flesta kemiska bindningar finns det dock fraktionsladdningar, vilket resulterar i ett tillstånd mellan kovalent och jonbindning.
Dipolmoment
En dipol är en molekyl där två poler – positiva och negativa – kan urskiljas. Dipolmomentet, betecknat med μ, är ett mått på storleken på den elektriska laddningsförskjutningen i den. Det definieras som produkten av det absoluta värdet av den elektriska laddningen (δ) som finns i en av polerna och avståndet från dessa poler (l): μ = δ · l En positiv laddning (δ+) och en negativ laddning ( δ-) kallas en partiell laddning och dess placering tillskrivs en viss atom, men i verkligheten är det bara den större eller mindre sannolikheten för att en elektron finns runt deras kärnor. Ett sådant fenomen förväxlas ibland med processerna för oxidation och reduktion , men till skillnad från de förändringar som sker i dem, gör sådana laddningar som tas på av atomerna inte att de flyttar till ett annat oxidationstillstånd, så det finns inget elektronutbyte mellan dem. SI-enheten för att uttrycka dipolmomentet är coulomb-mätaren (C·m). I beräkningar används dock oftast den enhet som skrivs i CGS-systemet, debye (D). En debye motsvarar ett värde på 3,33564·10 -30 C·m. Det största teoretiskt möjliga dipolmomentet kännetecknar molekyler med en rent jonbindning. Medan den minsta förekommer i molekyler vars bindning är rent kovalent – dipolmomentet är noll i detta fall. De flesta är dock mellanfall med olika partikelkaraktärer.
Halogendipolmoment
Flera samband mellan elektronegativitet och dipolmoment kan lätt observeras på specifika kemiska föreningar. Tabell 1 Dipolmoment för vätehalogenider
| Förening | Experimentellt bestämt dipolmoment [ μ, D] | Bindningslängd [pm] | Produkt av elementarladdning och dipollängd [e ·l, D] | Andel av jonisk karaktär [ %] | Skillnad i elektronegativiteten för halogen och väte |
| HF | 1,98 | 92 | 4,42 | 45 | 1.9 |
| HCl | 1.08 | 128 | 6.15 | 18 | 0,9 |
| HBr | 0,79 | 143 | 6,87 | 12 | 0,7 |
| HEJ | 0,38 | 162 | 7,78 | 5 | 0,4 |
Förhållandet μ/(e·l’), det vill säga det faktiska dipolmomentet till det dipolmoment som motsvarar en jonbindning, kan ge ett mått på avvikelser från den fullt kovalenta bindningen. Produkten av detta förhållande i form av (μ/(e·l’))·100%representerar procentandelen av jonkaraktären i bindningen. Detta är bara ett ungefärligt värde, eftersom dipolmomentet inte bara beror på bindningens polaritet, utan också på beteendet hos de fria elektronparen. Det händer att elektronmolnet kan förskjutas till utsidan av molekylen, vilket blir att ekvationen för att bestämma dess dipolmoment har en extra komponent. När det gäller ammoniakmolekylen riktas molnet i linje med bindningens dipolmoment, vilket resulterar i en ökning av det resulterande dipolmomentet. Däremot gäller motsatsen för kolmonoxidmolekylen, där molnet är riktat i motsatt riktning och följaktligen minskar det resulterande dipolmomentet. 
Elektronnegativitet
Det är en dimensionslös empirisk storhet som återspeglar tendensen hos en given atom i en molekyl att attrahera elektroner mot sig själv. I praktiken är det förmågan hos en atom eller funktionella grupper att attrahera elektrontäthet. Den mest använda skalan förknippad med denna kvantitet är den som introducerades av Linus Pauling, vilket gör det möjligt att enkelt beräkna bindningens ungefärliga karaktär. Forskaren använde följande metod för att beräkna elektronegativiteten för de enskilda elementen: Vi antar att D AA och D BB är bindningsenergierna för tvåatommolekylerna (A 2 , B 2 ). Vi betecknar den bindningsenergi som uppstår i molekylen som D AB . Empiriskt har det visat sig att om en sådan bindning innehåller liten eller ingen jonkaraktär, är skillnaden mellan DAB- värdena och det geometriska medelvärdet av D AA- och DBB- energivärdena lika med eller nära noll. När AB-bindningen har tydliga avvikelser från den kovalenta karaktären får denna skillnad positiva värden som ökar när andelen jonkaraktär ökar. Skillnaden mellan elektronegativiteten (x) för de två atomerna som är involverade i bindningen uttrycks med formeln: ![]() Därför, om Pauling antog en elektronegativitet för fluor på 4,0 i sina beräkningar, är det möjligt att beräkna den efterföljande elektronegativiteten för elementen. Om vi känner till x A- värdet för atomerna i element A och värdet på koefficienten Δ’ så kan vi beräkna x B- värdet med hjälp av ovanstående ekvation. Paulingskalan är konstruerad på ett sådant sätt att dess värden ungefär överensstämmer med värdena för dipolmomentet för bindningen som bildas av de aktuella atomerna, vilket vi kan se från exemplet i Tabell 1, som innehåller de värden som bestämts för vätehalogenider. . Utöver skalan som beskrivs ovan finns det flera fler beskrivna i den vetenskapliga litteraturen, inklusive elektronegativiteten som beskrivs av:
Därför, om Pauling antog en elektronegativitet för fluor på 4,0 i sina beräkningar, är det möjligt att beräkna den efterföljande elektronegativiteten för elementen. Om vi känner till x A- värdet för atomerna i element A och värdet på koefficienten Δ’ så kan vi beräkna x B- värdet med hjälp av ovanstående ekvation. Paulingskalan är konstruerad på ett sådant sätt att dess värden ungefär överensstämmer med värdena för dipolmomentet för bindningen som bildas av de aktuella atomerna, vilket vi kan se från exemplet i Tabell 1, som innehåller de värden som bestämts för vätehalogenider. . Utöver skalan som beskrivs ovan finns det flera fler beskrivna i den vetenskapliga litteraturen, inklusive elektronegativiteten som beskrivs av:
- Mulliken, vars arbete antog att ett elements elektronegativitet är direkt proportionell mot summan av dess elektronaffinitet och joniseringsenergi. Elektronaffinitet, som är mängden energi som frigörs på grund av att en elektron fäster en neutral atom, och joniseringsenergin lika med mängden energi som krävs för att frigöra en elektron från en neutral atom. De högsta elektronegativiteterna är därför karakteristiska för atomer som uppvisar hög elektronaffinitet och hög joniseringsenergi.
- Allred och Rochow, som antog proportionaliteten av elektronegativitet till måttet på kraften med vilken atomkärnan (Z) verkar på valenselektronerna, registrerade som
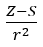 (r – atomradie, S – skärmningskonstant). Enligt deras teori kan elementens elektronegativitet (x) beräknas med formeln:
(r – atomradie, S – skärmningskonstant). Enligt deras teori kan elementens elektronegativitet (x) beräknas med formeln:
![]() På varje skala är vätgas elektronegativitet nära värdet 2,2, med andra värden som varierar något. Exempel på elektronegativiteten för elementaratomer beräknade enligt Pauling-, Mulliken- och Allred- och Rochow-skalorna visas i tabell 2 nedan. Tabell 2 Elektronegativiteter för exempelelement på skalorna Pauling (P), Mulliken (M) och Allred och Rochow (AR).
På varje skala är vätgas elektronegativitet nära värdet 2,2, med andra värden som varierar något. Exempel på elektronegativiteten för elementaratomer beräknade enligt Pauling-, Mulliken- och Allred- och Rochow-skalorna visas i tabell 2 nedan. Tabell 2 Elektronegativiteter för exempelelement på skalorna Pauling (P), Mulliken (M) och Allred och Rochow (AR).
| Atom | P | M | AR |
| F | 3,98 | 3,90 | 4.10 |
| O | 3,44 | 3.04 | 3,50 |
| N | 3.04 | 2.28 | 3.07 |
| Cl | 3.16 | 2,95 | 2,83 |
| C | 2,55 | 1,75 | 2,50 |
| H | 2.20 | 2.21 | 2.20 |
| Si | 1,90 | 2,25 | 1,74 |
| F | 0,82 | 0,77 | 0,91 |
| Rb | 0,82 | 0,50 | 0,89 |
| Cs | 0,79 | – | 0,86 |
| Fr | 0,70 | – | 0,86 |
Trots avvikelserna i beräkningarna med de tre metoderna har fluor högst elektronegativitet på varje skala, följt av syre, kväve och klor . De lägsta värdena bestämdes för francium, cesium, rubidium och kalium. Grundämnen som vanligtvis är icke-metaller har elektronegativitet över värdet 2, typiska metaller har elektronegativitet under 2. Standardvärdet är den tidigare nämnda elektronegativiteten för väte på cirka 2,2. 
Elektronegativitet i det periodiska systemet
Liksom många andra egenskaper återspeglas elektronegativitet också i arrangemanget av de kemiska elementen på det periodiska systemet . I gruppen minskar elektronegativiteten med ökande antal skal och metallisk karaktär, så den ökar i riktning från francium till väte. Med tiden ökar elektronegativiteten med en ökning av de närvarande valenselektronerna och en minskning av den icke-metalliska karaktären, så från metaller till ädelgaser .
Elektronegativitet och bindningstyp – sammanfattning
Genom att känna till de individuella värdena för elektronegativiteten hos de element som bildar den kemiska bindningen kan vi härleda dess natur. Om skillnaden är mellan 0,0 och 0,4 är bindningen kovalent. När skillnaden är mellan 0,4 och 1,7 är bindningen polariserad kovalent. En skillnad över 1,7 i elementens elektronegativitet tyder på jonbindning.
