เมื่อพิจารณาจากโครงสร้างแล้ว กรดคาร์บอกซิลิกเป็นสารประกอบอินทรีย์ที่สำคัญ และเป็นอนุพันธ์ของอะซิล เป็นวัสดุก่อสร้างชนิดหนึ่งสำหรับอนุพันธ์หลายชนิด รวมทั้งเอสเทอร์และเอไมด์ ในธรรมชาติ เราสามารถพบกรดคาร์บอกซิลิกหลากหลายชนิด เช่น กรดอะซิติก CH 3 COOH ซึ่งเป็นสารประกอบพื้นฐานของน้ำส้มสายชูบนโต๊ะ กรดบิวทีริก CH 3 CH 2 CH 2 COOH ที่เป็นตัวการทำให้เกิดกลิ่นหืนของเนย หรือมากกว่านั้น กรดโคลิคเชิงซ้อนซึ่งเป็นส่วนประกอบพื้นฐานของน้ำดีของมนุษย์

สูตรทั่วไปของกรดคาร์บอกซิลิกคือ:
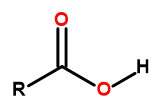
รูปที่ 1 สูตรทั่วไปของกรดคาร์บอกซิลิกคือ:
ศัพท์เฉพาะของกรดคาร์บอกซิลิก
ตามระบบการตั้งชื่อของ IUPAC กรดคาร์บอกซิลิกสามารถตั้งชื่อได้สองวิธี ขึ้นอยู่กับขนาดและความซับซ้อนของโมเลกุล กรดที่เป็นอนุพันธ์ของอะลิฟาติกได้รับการตั้งชื่ออย่างเป็นระบบโดยการเปลี่ยนอัลเคนที่ลงท้ายด้วย -ane เป็น -oic และเพิ่มคำว่า "กรด" ขึ้นต้น เช่น กรดโพรพาโนอิก กรดบิวทาโนอิก กรด 3-เอทิล-6-เมทิลออกเทนไดอิก เลขอะตอมของคาร์บอนในสารประกอบเคมีดังกล่าวจะเริ่มต้นด้วยอะตอมในกลุ่มฟังก์ชัน –COOH เสมอ ระบบการตั้งชื่อที่สอง ซึ่งมีประโยชน์อย่างยิ่งสำหรับกรดซึ่งหมู่คาร์บอกซิลติดอยู่กับวงแหวน ได้รับอนุญาตให้เพิ่มคำว่า "กรด" นำหน้าและ "คาร์บอกซิลิก" ตามหลังเป็นชื่อที่เป็นระบบของสารประกอบ ในกรณีเช่นนี้ การนับเลขอะตอมของคาร์บอนจะเริ่มต้นด้วยอะตอมที่มีหมู่คาร์บอกซิลเกาะอยู่ ซึ่งตัวมันเองถือเป็นองค์ประกอบแทนที่
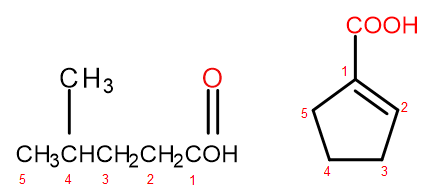
รูปที่ 2 จำนวนอะตอมของคาร์บอนใน จากซ้ายไปขวา: 4-methylpentanoic acid, 1-cyclopentenecarboxylic acid
| กรดคาร์บอกซิลิก | กลุ่มเอซิล | ||
| โครงสร้าง | ชื่อ | โครงสร้าง | ชื่อ |
| HCOOH | แบบฟอร์ม | HCO- | ฟอร์มิล- |
| CH 3 COOH | อะซิติก | CH 3 CO- | Acetyl- |
| CH 3 CH 2 CH 2 COOH | บิวทีริก | CH 3 CH 2 CH 2 CO- | บิวทิริล- |
| ฮู้คคู้ | ออกซาลิก | -OCCO- | ออกซาลิล- |
| ฮูค(CH 2 ) 2 COOH | ซัคซินิค | -OC(CH 2 ) 2 CO- | ซัคซินิล- |
โครงสร้างและคุณสมบัติทางกายภาพของกรดคาร์บอกซิลิก
ความคล้ายคลึงกันของหมู่คาร์บอกซิลกับทั้งคีโตนและแอลกอฮอล์อาจบ่งบอกถึงคุณสมบัติทางกายภาพที่คล้ายคลึงกัน เช่นเดียวกับคีโตน อะตอมของคาร์บอนในกลุ่มฟังก์ชันมีการผสมแบบ sp 2 สิ่งนี้เกี่ยวข้องโดยตรงกับโครงสร้างแบนราบและมุมประมาณ 120 o ระหว่างพันธะ CCO และ OCO ตัวอย่างเช่น กรดอะซิติก CH 3 COOH มีมุมพันธะเท่ากับ:
- 119 o สำหรับ CC=O
- 119 o สำหรับ CC-OH
- 122 o สำหรับ O=C-OH
ความยาวพันธะมีดังนี้:
- 52อัวสำหรับซีซี
- 25Å สำหรับ C=O,
- 31Å สำหรับ C-OH
กรดคาร์บอกซิลิกแสดงความคล้ายคลึงกับ แอลกอฮอล์ เนื่องจากความสัมพันธ์ที่แน่นแฟ้นซึ่งเกิดจากความเป็นไปได้ของการสร้างพันธะไฮโดรเจน ในทางปฏิบัติ สารประกอบเหล่านี้ส่วนใหญ่มีอยู่ในรูปของไซคลิกไดเมอร์ (cyclic dimers) ซึ่งมีโครงสร้างที่รักษาไว้โดยการสร้างพันธะไฮโดรเจน ระบบเฉพาะของพันธะไฮโดรเจนยังส่งผลต่อจุดเดือดของกรดคาร์บอกซิลิก มันทำให้เกิดการเพิ่มขึ้นอย่างมากเมื่อเทียบกับแอลกอฮอล์ที่เกี่ยวข้อง ตัวอย่างเช่น ค่าคงที่ทางกายภาพ – จุดหลอมเหลวและจุดเดือดเป็นองศาเซลเซียสตามลำดับ:
- กรดฟอร์มิก : 8.4; 100.7,
- กรดอะซิติก: 16.6; 117.9,
- กรดโพรพาโนอิก: -20.8; 141,
- กรดเบนโซอิก: 122.1; 249.
การแยกตัวของกรดคาร์บอกซิลิก
คุณสมบัติที่เป็นกรดของสารประกอบกลุ่มนี้ทำให้สามารถทำปฏิกิริยากับเบสได้ รวมทั้ง โซเดียมไฮดรอกไซด์ และโพแทสเซียมไบคาร์บอเนต ผลิตภัณฑ์ของปฏิกิริยาดังกล่าวคือเกลือของกรดคาร์บอกซิลิก ความสามารถในการละลายของกรดคาร์บอกซิลิกในน้ำนั้นเล็กน้อย แต่เกลือของพวกมันกับโลหะอัลคาไลเนื่องจากโครงสร้างไอออนิกนั้นละลายได้ดีในน้ำ สารประกอบเหล่านี้ซึ่งเป็นกรดในทฤษฎีของบรอนสเตด-โลว์รี จะแตกตัวในสารละลายที่มีน้ำเจือจาง อันเป็นผลมาจากการเปลี่ยนแปลงทำให้เกิดคาร์บอกซิเลตแอนไอออน RCOO – และไฮโดรเนียมไอออนบวก H 3 O +
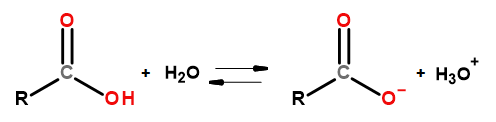
รูปที่ 3 แผนผังการแยกตัวของกรดคาร์บอกซิลิก
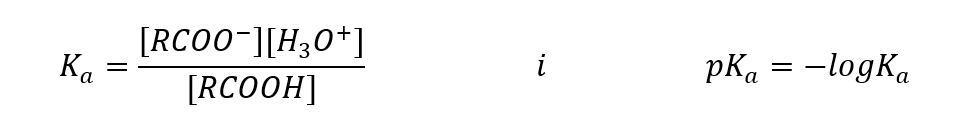 ค่าที่กำหนดโดยเชิงประจักษ์สำหรับกรดคาร์บอกซิลิกแสดงว่าพวกมันเป็นสารประกอบที่แตกตัวอย่างอ่อน ดังนั้นในทางปฏิบัติพวกมันจึงเป็นกรดอ่อนเช่นกัน สำหรับค่าคงที่ K ส่วน ใหญ่จะมีค่าประมาณ 10 -5 สำหรับกรดอะซิติก K a = 1.76·10 -5 ซึ่งหลังจากการแปลงแล้ว ให้ ค่า pK เท่ากับ 4.75 ซึ่งเท่ากับการแตกตัวของโมเลกุลเพียงประมาณ 0.1%ซึ่งเมื่อเปรียบเทียบกับกรดอนินทรีย์แก่ที่มีระดับการแยกตัว 100%เป็นการยืนยันว่ากรดเหล่านี้เป็นกรดที่มีความแรงต่ำ เมื่อเทียบกับแอลกอฮอล์ ซึ่งค่าคงที่สมดุลจะแกว่งตามลำดับความสำคัญ 10 -16 กรดคาร์บอกซิลิกจะแรงกว่ามาก แม้จะมีความคล้ายคลึงกันทางโครงสร้าง แต่ข้อเท็จจริงนี้เกิดจากความเสถียรของคาร์บอกซิเลตแอนไอออนที่สัมพันธ์กับอัลคอกไซด์แอนไอออน โปรดทราบว่าประจุลบในอัลคอกไซด์อยู่ในอะตอมออกซิเจนเดี่ยว ซึ่งมีอิเล็กโทรเนกาติตีสูง ในทางตรงกันข้าม ในคาร์บอกซิเลตแอนไอออน ประจุจะถูกแยกออกจากกันระหว่างออกซิเจนสองตัวของกลุ่มการทำงาน ทำให้มีเสถียรภาพมากขึ้นเมื่อเทียบกับไอออนที่ผลิตโดยแอลกอฮอล์
ค่าที่กำหนดโดยเชิงประจักษ์สำหรับกรดคาร์บอกซิลิกแสดงว่าพวกมันเป็นสารประกอบที่แตกตัวอย่างอ่อน ดังนั้นในทางปฏิบัติพวกมันจึงเป็นกรดอ่อนเช่นกัน สำหรับค่าคงที่ K ส่วน ใหญ่จะมีค่าประมาณ 10 -5 สำหรับกรดอะซิติก K a = 1.76·10 -5 ซึ่งหลังจากการแปลงแล้ว ให้ ค่า pK เท่ากับ 4.75 ซึ่งเท่ากับการแตกตัวของโมเลกุลเพียงประมาณ 0.1%ซึ่งเมื่อเปรียบเทียบกับกรดอนินทรีย์แก่ที่มีระดับการแยกตัว 100%เป็นการยืนยันว่ากรดเหล่านี้เป็นกรดที่มีความแรงต่ำ เมื่อเทียบกับแอลกอฮอล์ ซึ่งค่าคงที่สมดุลจะแกว่งตามลำดับความสำคัญ 10 -16 กรดคาร์บอกซิลิกจะแรงกว่ามาก แม้จะมีความคล้ายคลึงกันทางโครงสร้าง แต่ข้อเท็จจริงนี้เกิดจากความเสถียรของคาร์บอกซิเลตแอนไอออนที่สัมพันธ์กับอัลคอกไซด์แอนไอออน โปรดทราบว่าประจุลบในอัลคอกไซด์อยู่ในอะตอมออกซิเจนเดี่ยว ซึ่งมีอิเล็กโทรเนกาติตีสูง ในทางตรงกันข้าม ในคาร์บอกซิเลตแอนไอออน ประจุจะถูกแยกออกจากกันระหว่างออกซิเจนสองตัวของกลุ่มการทำงาน ทำให้มีเสถียรภาพมากขึ้นเมื่อเทียบกับไอออนที่ผลิตโดยแอลกอฮอล์
การได้รับกรดคาร์บอกซิลิก
- ออกซิเดชันของอัลคิลเบนซีนที่ถูกแทนที่ด้วย KMnO 4 หรือ Na 2 Cr 2 O 7 ด้วยผลิตภัณฑ์ในรูปของกรดเบนโซอิกที่ถูกแทนที่ เป็นไปได้ที่จะออกซิไดซ์หมู่อัลคิลปฐมภูมิและทุติยภูมิ
- ออกซิเดชันของพันธะ C=C ในอัลคีนที่มีอะตอมไวนิลไฮโดรเจนอย่างน้อยหนึ่งอะตอมโดยใช้ KMnO 4 ,
- ออกซิเดชันของแอลกอฮอล์ปฐมภูมิและอัลดีไฮด์ แอลกอฮอล์ที่ใช้ตัวทำปฏิกิริยาโจนส์ อัลดีไฮด์ที่ใช้ตัวทำปฏิกิริยาเดียวกันและซิลเวอร์ออกไซด์พื้นฐาน
- การไฮโดรไลซิสของไนไตรล์ภายใต้อิทธิพลของสารละลายกรดหรือเบสแก่ที่ร้อนจัด
- ปฏิกิริยาของสารประกอบ Grignard กับคาร์บอนไดออกไซด์กับผลิตภัณฑ์ขั้นกลางในรูปของแมกนีเซียมคาร์บอกซิเลต จากนั้นสารประกอบทรานซิชันจะทำปฏิกิริยากับกรด
ปฏิกิริยาของกรดคาร์บอกซิลิก
เนื่องจากโครงสร้างของกรดคาร์บอกซิลิก นอกเหนือจากปฏิกิริยาที่มีลักษณะเฉพาะแล้ว ยังผ่านการเปลี่ยนแปลงที่คล้ายกับแอลกอฮอล์และคีโตนอีกด้วย เช่นเดียวกับแอลกอฮอล์ พวกมันสามารถแยกโปรตอนออกเพื่อสร้างสารทำปฏิกิริยานิวคลีโอฟิลิก เช่นเดียวกับคีโตน พวกมันอาจถูกโจมตีโดยนิวคลีโอฟิลตัวอื่นบนอะตอมของคาร์บอนของหมู่คาร์บอนิล นอกจากนี้ การลดลง การแทนที่ในตำแหน่งอัลฟ่า การแทนที่ด้วยนิวคลีโอฟิลิกของกลุ่ม acyl และการสลายตัว การลดลงของกรดคาร์บอกซิลิกเกิดขึ้นกับ LiAlH 4 โดยให้ผลิตภัณฑ์เป็นแอลกอฮอล์หลัก บางครั้งจำเป็นต้องใช้ความร้อนในสารละลายเตตระไฮโดรฟิวแรนเพื่อเพิ่มประสิทธิภาพ อีกวิธีหนึ่งคือการลดลงโดยใช้โบเรนในสารละลายเตตระไฮโดรฟิวแรน ซึ่งได้แอลกอฮอล์ 1 o เช่นกัน
