ระดับค่า pH ใช้เพื่อกำหนดระดับความเป็นกรดหรือด่างของสารละลายในระดับเชิงปริมาณที่มีตัวเลขสัมบูรณ์ตั้งแต่ 0 ถึง 14 โดยจะขึ้นอยู่กับกิจกรรมโมลาร์ของไฮโดรเนียมไอออน [H 3 O +] ในของเหลวที่ทดสอบ มาตราส่วนได้รับการพัฒนาในปี 1909 โดยนักชีวเคมีชาวเดนมาร์ก S. Sorensen และตัวอักษร 'p' และ 'H' ย่อมาจากภาษาละติน 'potentio' (กำลัง) และอะตอมของไฮโดรเจน ซึ่งแสดงอยู่ในตารางธาตุ เป็น 'H' (ไฮโดรเจน) สเกลค่า pH สะท้อนทั้งค่าหนึ่งและค่าอื่นๆ: ในการกำหนดระดับค่า pH เราใช้เลขชี้กำลังที่มีเครื่องหมายที่เปลี่ยนไปเพื่ออ้างอิงถึงโปรตอนที่มีไฮโดรเจน ระดับค่า pH ของสารละลายใดๆ ที่ผลิตขึ้นเป็นหนึ่งในคุณลักษณะทางเคมีที่สำคัญที่สุดและเป็นปัจจัยที่กำหนดแนวทางและความเร็วของปฏิกิริยาเคมีต่างๆ ตลอดจนชนิดของสารที่ผลิตขึ้น

ความแตกต่างในระดับ
ระดับค่า pH ประกอบด้วย 15 องศา โดยที่ค่ากลาง (7) หมายถึงค่า pH ที่เป็นกลาง สารละลายที่อยู่ใกล้ 0 เรียกว่า กรดแก่ ส่วนสารละลายที่อยู่ฝั่งตรงข้าม ใกล้กับ 14 เรียกว่า เบสแก่ ค่า pH ที่เป็นกรดหมายความว่าสารละลายมีไฮโดรเจนไอออน [H 3 O +] มากเกินไป และค่า pH พื้นฐานหมายความว่ามีไฮดรอกไซด์ไอออน [OH –] มากเกินไป ระดับค่า pH มักถูกอ้างถึงในบริบทของสารละลาย แต่ศักยภาพทางเคมีสัมบูรณ์ของโปรตอนทำให้ค่านี้สามารถใช้ได้ในทุกสถานะของการรวมตัว สิ่งนี้ทำให้เราสามารถเปรียบเทียบระดับความเป็นด่างของสารแทบทุกชนิดได้โดยตรง
การแยกตัวของน้ำ
เพื่อให้เข้าใจความรู้สึกของระดับค่า pH อย่างถ่องแท้ เราจำเป็นต้องมีปฏิกิริยาที่เกิดขึ้นเองของการแยกตัวของน้ำ ซึ่งดำเนินการตามสมการต่อไปนี้:  เป็นกระบวนการที่ผันกลับได้ซึ่งค่าคงที่สมดุลจะเลื่อนไปทางด้านซ้ายของสมการ กล่าวคือ ไปทางน้ำที่ไม่แยกออกจากกัน
เป็นกระบวนการที่ผันกลับได้ซึ่งค่าคงที่สมดุลจะเลื่อนไปทางด้านซ้ายของสมการ กล่าวคือ ไปทางน้ำที่ไม่แยกออกจากกัน
จะคำนวณระดับ pH ได้อย่างไร?
แม้จะมีข้อสันนิษฐานเบื้องต้นที่กำหนดไว้อย่างผิดพลาดว่าการตรวจวัดเกี่ยวข้องกับความเข้มข้นของไฮโดรเจนไอออน [H +] แต่สูตรที่ได้รับความนิยมมากที่สุดยังคงเป็นดังนี้:  วันนี้เรารู้แล้วว่าสารละลายไม่มีไอออนของไฮโดรเจนในน้ำ เช่น โปรตอนที่มีอยู่ในน้ำ เนื่องจากกระบวนการละลายในทันที ปรากฏการณ์นี้ส่งผลให้เกิดการขาดโปรตอนอิสระและการมีอยู่ของไฮโดรเนียมไอออน [H 3 O +] ซึ่งเกิดจากปฏิกิริยาที่เกิดขึ้นเองและไม่สามารถย้อนกลับได้:
วันนี้เรารู้แล้วว่าสารละลายไม่มีไอออนของไฮโดรเจนในน้ำ เช่น โปรตอนที่มีอยู่ในน้ำ เนื่องจากกระบวนการละลายในทันที ปรากฏการณ์นี้ส่งผลให้เกิดการขาดโปรตอนอิสระและการมีอยู่ของไฮโดรเนียมไอออน [H 3 O +] ซึ่งเกิดจากปฏิกิริยาที่เกิดขึ้นเองและไม่สามารถย้อนกลับได้: 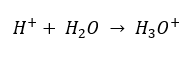 ดังนั้นสัญกรณ์ที่ถูกต้องของสูตรจะเป็นดังนี้:
ดังนั้นสัญกรณ์ที่ถูกต้องของสูตรจะเป็นดังนี้: 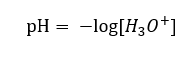
สภาพแวดล้อมที่แสดงในระดับค่า pH
สันนิษฐานว่าความเข้มข้นของไฮโดรเนียมไอออนในน้ำบริสุทธิ์ที่อุณหภูมิห้อง (25 o C) คือ 10 -7 โมล/เดซิเมตร 3 จึงสามารถคำนวณระดับ pH ได้ดังนี้: 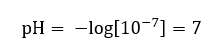 สิ่งนี้สอดคล้องกับข้อเท็จจริงที่ว่าน้ำที่เป็นกลางอยู่ในตำแหน่งตรงกลางของมาตราส่วนซึ่งบ่งบอกถึงความเฉื่อยทางเคมีของสาร นอกจากนี้ยังพิสูจน์ว่าน้ำมีไฮดรอกไซด์แอนไอออนและไฮโดรเนียมไอออนบวกในจำนวนที่เท่ากัน อย่างไรก็ตาม ในกรดและเบส สมดุลนั้นจะถูกรบกวน เลขชี้กำลังที่เป็นลบแสดงถึงความสัมพันธ์ที่ระดับค่า pH ยิ่งต่ำ พลังของสารละลายที่ทดสอบก็จะยิ่งสูงขึ้น คำว่า ‘กำลัง’ ในบริบทของมาตราส่วนค่า pH หมายถึงความจริงที่ว่าค่า 0 มาจากกรดแก่ที่มีฤทธิ์ระคายเคือง ในขณะที่ค่า 14 หมายถึงสารที่เป็นด่างที่แรงที่สุด
สิ่งนี้สอดคล้องกับข้อเท็จจริงที่ว่าน้ำที่เป็นกลางอยู่ในตำแหน่งตรงกลางของมาตราส่วนซึ่งบ่งบอกถึงความเฉื่อยทางเคมีของสาร นอกจากนี้ยังพิสูจน์ว่าน้ำมีไฮดรอกไซด์แอนไอออนและไฮโดรเนียมไอออนบวกในจำนวนที่เท่ากัน อย่างไรก็ตาม ในกรดและเบส สมดุลนั้นจะถูกรบกวน เลขชี้กำลังที่เป็นลบแสดงถึงความสัมพันธ์ที่ระดับค่า pH ยิ่งต่ำ พลังของสารละลายที่ทดสอบก็จะยิ่งสูงขึ้น คำว่า ‘กำลัง’ ในบริบทของมาตราส่วนค่า pH หมายถึงความจริงที่ว่าค่า 0 มาจากกรดแก่ที่มีฤทธิ์ระคายเคือง ในขณะที่ค่า 14 หมายถึงสารที่เป็นด่างที่แรงที่สุด
การเติมกรดลงในน้ำ
การเปลี่ยนแปลงค่า pH จากระดับที่เป็นกลางอาจเกิดจากการเติมสารที่มีกำลังต่างกัน ตัวอย่างเช่น ถ้าเราเติมกรดที่แรงที่สุด ( กรดไฮโดรคลอริก, HCl ) ลงในน้ำ กรดนั้นจะทำให้กรดแตกตัวตามปฏิกิริยาต่อไปนี้:  สมดุลของการแยกตัวของกรดจะเลื่อนไปทางขวาอย่างมีนัยสำคัญ ซึ่งแตกต่างจากการแยกตัวของน้ำ ดังนั้นหากกรดนั้นละลายในน้ำเฉื่อยต่อสิ่งแวดล้อม มันจะเพิ่มปริมาณของไฮโดรเนียมไอออนที่มีอยู่ในน้ำ และเป็นผลให้กิจกรรมโมลาร์เพิ่มขึ้น เพื่อยกตัวอย่าง ตามปฏิกิริยาการแตกตัว กรดไฮโดรคลอริกเข้มข้นที่ 1 โมล/เดซิเมตร 3 จะได้สารละลายไฮโดรเนียมไอออนเข้มข้นที่ 1 โมล/เดซิเมตร 3 ระดับ pH สำหรับสารละลายกรดไฮโดรคลอริกสามารถคำนวณได้จากสูตรต่อไปนี้:
สมดุลของการแยกตัวของกรดจะเลื่อนไปทางขวาอย่างมีนัยสำคัญ ซึ่งแตกต่างจากการแยกตัวของน้ำ ดังนั้นหากกรดนั้นละลายในน้ำเฉื่อยต่อสิ่งแวดล้อม มันจะเพิ่มปริมาณของไฮโดรเนียมไอออนที่มีอยู่ในน้ำ และเป็นผลให้กิจกรรมโมลาร์เพิ่มขึ้น เพื่อยกตัวอย่าง ตามปฏิกิริยาการแตกตัว กรดไฮโดรคลอริกเข้มข้นที่ 1 โมล/เดซิเมตร 3 จะได้สารละลายไฮโดรเนียมไอออนเข้มข้นที่ 1 โมล/เดซิเมตร 3 ระดับ pH สำหรับสารละลายกรดไฮโดรคลอริกสามารถคำนวณได้จากสูตรต่อไปนี้: 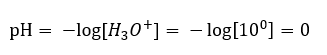
การเติมเบสลงในน้ำ
ในกรณีตรงกันข้าม เมื่อเราเติมเบสแก่ลงในน้ำ ความเข้มข้นของไฮโดรเนียมไอออนจะลดลง ตัวอย่างเช่น โซเดียมไฮดรอกไซด์ ที่มีความเข้มข้น 1 โมล/เดซิเมตร 3 จะมีความเข้มข้นเท่ากัน แต่มีไอออนอื่นๆ (ไฮดรอกไซด์ไอออน) ตามปฏิกิริยาที่เกิดขึ้นภายใต้อิทธิพลของน้ำ:  ในกรณีเช่นนี้ เป็นไปได้ที่จะคำนวณค่า pH ทางอ้อมโดยใช้สูตรเสริม pOH ต่อไปนี้:
ในกรณีเช่นนี้ เป็นไปได้ที่จะคำนวณค่า pH ทางอ้อมโดยใช้สูตรเสริม pOH ต่อไปนี้: 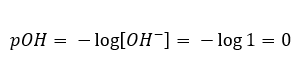 ถ้าเรารู้ว่า:
ถ้าเรารู้ว่า: 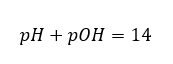 เราสามารถคำนวณได้อย่างง่ายดายว่าค่า pH ของสารละลายเบสแก่ (NaOH) ที่มีความเข้มข้น 1 โมล/เดซิเมตร 3 มีค่า pH เท่ากับ 14
เราสามารถคำนวณได้อย่างง่ายดายว่าค่า pH ของสารละลายเบสแก่ (NaOH) ที่มีความเข้มข้น 1 โมล/เดซิเมตร 3 มีค่า pH เท่ากับ 14 
ระดับค่า pH นอกสเกล?
เนื่องจากเดิมทีสเกลค่า pH ได้รับการพัฒนาเพื่อจุดประสงค์ของสารละลายเจือจาง จึงมีความเป็นไปได้ที่กรดแก่หรือเบสแก่จะเกินค่าดังกล่าว โดยมีค่าต่ำกว่า 0 หรือสูงกว่า 14 เนื่องจากสเกลนี้ไม่มีประโยชน์สำหรับความเข้มข้นสูงที่ค่า pH ไม่เป็นลอการิทึมอีกต่อไป ฟังก์ชันของไฮโดรเนียมไอออน [H 3 O +] จากนั้นเราใช้ค่าต่าง ๆ ซึ่งเกิดขึ้นจากความสมดุลคงที่ของ การแยกตัวของกรด และเบส
วิธีการหาค่า pH ของสารละลาย
ในการหาค่า pH ของสิ่งแวดล้อมในเชิงประจักษ์ เราใช้ตัวบ่งชี้กรด-เบสที่เรียกว่า ในทางปฏิบัติ สารเหล่านี้เป็นสารที่เปลี่ยนสีเมื่อได้รับผลกระทบจากสภาวะ pH ที่แตกต่างกัน ตัวบ่งชี้ดังกล่าวมีสามประเภท:
- ตัวบ่งชี้ที่เปลี่ยนสีในสภาพแวดล้อมพื้นฐาน เช่น:
- ฟีนอล์ฟทาลีนที่ไม่มีสีกลายเป็นสีราสเบอร์รี่
- thymolphtalein ไม่มีสี เปลี่ยนเป็นสีน้ำเงิน
- อินดิเคเตอร์ที่เปลี่ยนสีในสภาพแวดล้อมที่เป็นกรด เช่น
- เมทิลออเรนจ์เปลี่ยนสีจากสีส้มเป็นสีแดง
- โบรโมไทมอลบลูเปลี่ยนสีจากสีน้ำเงินเป็นสีเหลือง
- ตัวบ่งชี้สากล ตัวอย่างเช่น:
- โบรโมไทมอลบลูเปลี่ยนเป็นสีเหลืองในกรดและสีน้ำเงินในเบส
- แลคมัสเปลี่ยนเป็นสีแดงในกรดหรือเป็นสีน้ำเงินในเบส
เป็นเรื่องปกติเช่นกันที่จะแช่กระดาษลิตมัสในส่วนผสมของสารบ่งชี้ต่างๆ ซึ่งจะเพิ่มช่วงของระดับ pH นอกจากนี้ ห้องปฏิบัติการหลายแห่งใช้กระดาษลิตมัสสากลสำเร็จรูปที่เปลี่ยนสีในช่วงจากสีแดงเป็นสีเขียว เพื่อแนะนำค่า pH ที่ทดสอบตามสเกลที่แนบมาอย่างเหมาะสม การกำหนดดังกล่าวช่วยให้เราประเมินเฉพาะค่า pH ที่มีความแม่นยำ 0.5 หน่วยในระดับ pH วิธีการวัดค่า pH ที่แม่นยำยิ่งขึ้นคือการไทเทรตกรด-เบส ซึ่งรวมถึงประเภทย่อยของอัลคาลิเมทรี (การไทเทรตด้วยสารละลายเบสที่ได้มาตรฐาน) และการวัดความเป็นกรด (การไทเทรตด้วยสารละลายกรดมาตรฐาน) ใช้ไทแทรนต์ที่มีความเข้มข้นที่ทราบ ซึ่งเมื่อทำปฏิกิริยากับสารทดสอบ ความเข้มข้นของไฮโดรเนียมไอออนในสารละลายจะแปรผันอย่างต่อเนื่อง การกำหนดดังกล่าวอาจทำได้สองวิธี: การมองเห็นเมื่อกำหนดจุดสิ้นสุดพร้อมกับการเปลี่ยนสีหรือการใช้วิธีเครื่องมือ ตัวอย่างเช่น โพเทนชิโอเมทรีหรือการนำไฟฟ้า ตามชื่อที่แนะนำ การใช้เครื่องวัดค่า pH ช่วยให้เราสามารถกำหนดค่า pH ของสารได้ เครื่องมือนี้ทำงานโดยใช้โพเทนชิโอเมตรี มีเซลล์ในขั้วไฟฟ้าที่เหมือนกันสองขั้ว หนึ่งในนั้นเรียกว่า อิเล็กโทรดตัวบ่งชี้ ควรใส่ลงในสารละลายที่ทดสอบ อีกอันหนึ่ง (อิเล็กโทรดเปรียบเทียบ) ถูกใส่ลงในสารละลายมาตรฐานที่มีค่า pH ที่ทราบ สารที่ใช้กันทั่วไปคือสารละลายซิลเวอร์คลอไรด์ อิเล็กโทรดทั้งสองเชื่อมต่อกับโวลต์มิเตอร์ที่มีความไวสูงมาก ซึ่งจะแปลง EMF (แรงเคลื่อนไฟฟ้า) อย่างต่อเนื่องให้เป็นผลลัพธ์เฉพาะในระดับค่า pH ตามทฤษฎีของ Nernst แรงเคลื่อนไฟฟ้าของเซลล์ (EMF) ประกอบด้วยขั้วไฟฟ้าที่เหมือนกันสองขั้วที่แช่อยู่ในสารละลายที่มีค่า pH ต่างกัน เป็นสัดส่วนโดยตรงกับลอการิทึมของผลหารของความเข้มข้นทั้งสอง
วิธีการวัดค่า pH ที่บ้าน
ปรากฎว่ามี ตัวบ่งชี้ค่า pH ตามธรรมชาติมากมาย และสามารถวัดค่า pH โดยประมาณได้ในสภาพแวดล้อมภายในบ้าน ตัวอย่างเช่น การแช่ใบชาดำจะสว่างขึ้นเมื่อผสมกับกรด เช่น น้ำมะนาว ในทางกลับกัน สีจะเข้มขึ้นภายใต้อิทธิพลของเบส เช่น สารละลายเบกกิ้งโซดา น้ำกะหล่ำปลีแดงเปลี่ยนสีจากสีม่วงเป็นสีแดงเมื่ออยู่ภายใต้กรดหรือเป็นสีน้ำเงินเมื่อผสมกับเบส
