ปริมาณสัมพันธ์เป็นสาขาวิชาเคมีทั่วไปที่เกี่ยวข้องกับการคำนวณเกี่ยวกับปฏิกิริยาเคมีเชิงปริมาณ เมื่อทำงานในห้องปฏิบัติการ บ่อยครั้งจำเป็นต้องทราบปริมาณ (มวล ปริมาตร โมเลกุล) ของสารตั้งต้นที่เราต้องใช้เพื่อให้ปฏิกิริยาเคมีที่เรากำลังดำเนินการเกิดขึ้นอย่างสมบูรณ์หรือเพื่อให้ได้ปริมาณของผลิตภัณฑ์ พวกเราต้องการ. บางครั้งก็จำเป็นต้องคำนวณวัสดุพิมพ์ส่วนเกินหรือขาดซึ่งทำให้การทดสอบทำงานแตกต่างไปจากที่คาดไว้ การคำนวณแต่ละครั้งเป็นไปตามการตีความเชิงปริมาณของสมการปฏิกิริยาเคมีโดยตรง และใช้กฎการอนุรักษ์มวล สมการประเภทนี้เรียกว่าการคำนวณปริมาณสัมพันธ์

เราต้องรู้อะไรบ้าง?
ในการใช้ปริมาณสัมพันธ์ เราต้องมีความรู้ในหลายด้าน รวมถึง สมการปฏิกิริยาเคมี สัมประสิทธิ์ปริมาณสัมพันธ์ มวลโมลและโมลาร์ และปริมาตรโมลาร์ของก๊าซ และกฎของอาโวกาโดร การใช้ความรู้เรื่องปริมาณสัมพันธ์ของปฏิกิริยาเคมีสามารถแก้ไขปัญหาการคำนวณหลายอย่างได้ เช่น:
- การวิเคราะห์องค์ประกอบ
- การคำนวณฟันกราม
- การคำนวณมวล
- การคำนวณของผสมที่ไม่ใช่ปริมาณสัมพันธ์กับความเป็นไปได้ในการกำหนดสารจำกัดในปฏิกิริยา
- ผลผลิตปฏิกิริยา
มวลกราม
เนื่องจากอะตอมและโมเลกุลแต่ละตัวมีมวลน้อยอย่างไม่น่าเชื่อ หน่วย (u) ที่แสดงมวลอะตอมจึงถูกสร้างขึ้น ในทางปฏิบัติ ค่านี้มีค่าเท่ากับ 1/12 ของมวลไอโซโทปคาร์บอน 12 C สารส่วนนี้มีความสัมพันธ์อย่างใกล้ชิดกับ ค่าคงที่ t ของอาโวกาโดร และถูกกำหนดให้เป็นจำนวนกรัมของสารที่มี 6.022·10 23 อะตอม โมเลกุล หรือไอออน มวลโมลาร์ [M] เป็นตัวเลขเท่ากับมวลอะตอมหรือ โมเลกุล และมีหน่วยเป็น g/mol
ปริมาตรโมลของสาร [Vm]
นี่เป็นค่าเฉพาะของสารซึ่งขึ้นอยู่กับสภาวะของอุณหภูมิและความดันอย่างมาก นี่คือปริมาตรของสารที่ถูกครอบครองโดยหนึ่งโมลของมัน ภายใต้สภาวะปกติจะใช้ค่าคงที่ 22.4 dm 3
กฎขององค์ประกอบคงที่และการอนุรักษ์มวล
สารประกอบเคมีทุกชนิด โดยไม่คำนึงถึงแหล่งกำเนิดและวิธีการได้มา ล้วนมีองค์ประกอบเชิงคุณภาพและเชิงปริมาณที่กำหนดไว้อย่างดีและสม่ำเสมอ ตัวอย่างเช่น ซัลเฟอร์ (IV) ออกไซด์จะมีซัลเฟอร์ 50%โดยน้ำหนักเสมอ และซัลเฟอร์ (VI) ออกไซด์ 40%โดยน้ำหนักขององค์ประกอบนี้เสมอ ในระบบปิด มวลของผลิตภัณฑ์ที่ได้จะเท่ากับมวลของ สารตั้งต้น ที่ใช้ระหว่างการทำปฏิกิริยา กฎการอนุรักษ์มวลสะท้อนให้เห็นในความจำเป็นในการสร้างสมดุลของสมการปฏิกิริยาเคมีแต่ละสมการด้วยค่าสัมประสิทธิ์เคมีที่เหมาะสม เพื่อให้ทั้งสองด้านของสมการเท่ากันในแง่ของจำนวนอะตอมที่มีอยู่ อัตราส่วนปริมาณสัมพันธ์สะท้อนถึงอัตราส่วนโมลของสารตั้งต้นที่มีอยู่ในปฏิกิริยาเคมี
สมการปฏิกิริยาเคมี
ข้อมูลทั้งหมดที่จำเป็นเกี่ยวกับความสัมพันธ์สัมพัทธ์ระหว่างสารเคมีได้มาจากสมการปฏิกิริยาเคมีของสารเหล่านั้น ให้ข้อมูลที่เกี่ยวข้องและเชิงปริมาณที่สำคัญ
ตัวอย่างที่ 1
จากสมการการสังเคราะห์ แอมโมเนีย ซึ่งเป็นไปตามปฏิกิริยา: ![]() เราสามารถตีความได้หลายอย่าง – โมเลกุล โมลาร์ มวลโมลาร์ ปริมาตรโมล และเลขโมเลกุล ก) ในทางโมเลกุล เราสามารถอ่านได้ว่าไฮโดรเจนสามโมเลกุลทำปฏิกิริยากับไนโตรเจนหนึ่งโมเลกุลจนเกิดเป็นแอมโมเนียสองโมเลกุล b) นอกจากนี้ยังหมายความว่าไฮโดรเจนสามโมลทำปฏิกิริยากับไนโตรเจนหนึ่งโมลจนเกิดผลคูณของแอมโมเนียสองโมล c) การใช้ ตารางธาตุขององค์ประกอบทางเคมี ซึ่งมีมวลโมลาร์ของแต่ละอะตอม เราสามารถสรุปได้จากสมการว่าไฮโดรเจน 6 กรัมทำปฏิกิริยากับไนโตรเจน 28 กรัมจนเกิดเป็นแอมโมเนีย 34 กรัม d) จากนั้น สมมติว่าอยู่ในสภาวะปกติ เรารู้ว่าก๊าซหนึ่งโมลครอบครอง 22.4 dm 3 สิ่งนี้ช่วยให้เราสรุปได้ว่าไฮโดรเจน 67.2 dm 3 ทำปฏิกิริยากับไนโตรเจน 22.4 dm 3 ทำให้เกิดแอมโมเนีย 44.8 dm 3 e) ความสัมพันธ์ที่เป็นประโยชน์อีกประการหนึ่งคือกฎของอาโวกาโดร ซึ่งระบุว่าก๊าซต่างชนิดที่มีปริมาตรเท่ากันจะมีอนุภาคจำนวนเท่ากันภายใต้สภาวะความดันและอุณหภูมิเดียวกัน เมื่อทราบค่าคงที่ของ Avogadro ที่ 6.022·10 23 เรา รู้ว่าเราต้องการโมเลกุลไฮโดรเจน 3·6.022·10 23 และโมเลกุลไนโตรเจน 6.022·10 23 เพื่อทำปฏิกิริยาทางเคมีที่สมบูรณ์สำหรับการสังเคราะห์แอมโมเนีย ปฏิกิริยาจะได้โมเลกุลแอมโมเนีย 2·6.022·10 23
เราสามารถตีความได้หลายอย่าง – โมเลกุล โมลาร์ มวลโมลาร์ ปริมาตรโมล และเลขโมเลกุล ก) ในทางโมเลกุล เราสามารถอ่านได้ว่าไฮโดรเจนสามโมเลกุลทำปฏิกิริยากับไนโตรเจนหนึ่งโมเลกุลจนเกิดเป็นแอมโมเนียสองโมเลกุล b) นอกจากนี้ยังหมายความว่าไฮโดรเจนสามโมลทำปฏิกิริยากับไนโตรเจนหนึ่งโมลจนเกิดผลคูณของแอมโมเนียสองโมล c) การใช้ ตารางธาตุขององค์ประกอบทางเคมี ซึ่งมีมวลโมลาร์ของแต่ละอะตอม เราสามารถสรุปได้จากสมการว่าไฮโดรเจน 6 กรัมทำปฏิกิริยากับไนโตรเจน 28 กรัมจนเกิดเป็นแอมโมเนีย 34 กรัม d) จากนั้น สมมติว่าอยู่ในสภาวะปกติ เรารู้ว่าก๊าซหนึ่งโมลครอบครอง 22.4 dm 3 สิ่งนี้ช่วยให้เราสรุปได้ว่าไฮโดรเจน 67.2 dm 3 ทำปฏิกิริยากับไนโตรเจน 22.4 dm 3 ทำให้เกิดแอมโมเนีย 44.8 dm 3 e) ความสัมพันธ์ที่เป็นประโยชน์อีกประการหนึ่งคือกฎของอาโวกาโดร ซึ่งระบุว่าก๊าซต่างชนิดที่มีปริมาตรเท่ากันจะมีอนุภาคจำนวนเท่ากันภายใต้สภาวะความดันและอุณหภูมิเดียวกัน เมื่อทราบค่าคงที่ของ Avogadro ที่ 6.022·10 23 เรา รู้ว่าเราต้องการโมเลกุลไฮโดรเจน 3·6.022·10 23 และโมเลกุลไนโตรเจน 6.022·10 23 เพื่อทำปฏิกิริยาทางเคมีที่สมบูรณ์สำหรับการสังเคราะห์แอมโมเนีย ปฏิกิริยาจะได้โมเลกุลแอมโมเนีย 2·6.022·10 23
ตัวอย่างที่ 2
ปฏิกิริยาการเผาไหม้ของแมกนีเซียมในคลอรีนเกิดขึ้นตามสมการ: ![]() ช่วยให้เราสามารถตีความได้คล้ายกับตัวอย่างก่อนหน้านี้ ก) แม้จะดูแวบแรก สมการที่นำเสนอก็ช่วยให้เราสรุปได้ว่า เพื่อให้ได้ แมกนีเซียมคลอไรด์ หนึ่งโมเลกุล เราต้องจัดหาแมกนีเซียมหนึ่งโมเลกุลและคลอรีนหนึ่งโมเลกุลเป็นสารตั้งต้น b) ซึ่งแน่นอนว่าเทียบเท่ากับจำนวนโมลที่มีอยู่ในระบบ เช่น แมกนีเซียม 1 โมล คลอรีน 1 โมล แมกนีเซียมคลอไรด์ 1 โมล c) สำหรับการคำนวณมวล เรารู้ว่าแมกนีเซียม 24 กรัมทำปฏิกิริยากับคลอรีน 71 กรัม ทำให้เกิดแมกนีเซียมคลอไรด์ 95 กรัม d) เนื่องจากมีก๊าซ คลอรีน เพียงชนิดเดียวเท่านั้นที่เกี่ยวข้องกับปฏิกิริยาเคมีภายใต้การพิจารณา เราจึงสามารถเขียนได้ว่ามีปริมาตร 22.4 dm 3 จ) ในการนับอนุภาค แต่ละองค์ประกอบจะเท่ากันและรับค่า 6.022·10 23
ช่วยให้เราสามารถตีความได้คล้ายกับตัวอย่างก่อนหน้านี้ ก) แม้จะดูแวบแรก สมการที่นำเสนอก็ช่วยให้เราสรุปได้ว่า เพื่อให้ได้ แมกนีเซียมคลอไรด์ หนึ่งโมเลกุล เราต้องจัดหาแมกนีเซียมหนึ่งโมเลกุลและคลอรีนหนึ่งโมเลกุลเป็นสารตั้งต้น b) ซึ่งแน่นอนว่าเทียบเท่ากับจำนวนโมลที่มีอยู่ในระบบ เช่น แมกนีเซียม 1 โมล คลอรีน 1 โมล แมกนีเซียมคลอไรด์ 1 โมล c) สำหรับการคำนวณมวล เรารู้ว่าแมกนีเซียม 24 กรัมทำปฏิกิริยากับคลอรีน 71 กรัม ทำให้เกิดแมกนีเซียมคลอไรด์ 95 กรัม d) เนื่องจากมีก๊าซ คลอรีน เพียงชนิดเดียวเท่านั้นที่เกี่ยวข้องกับปฏิกิริยาเคมีภายใต้การพิจารณา เราจึงสามารถเขียนได้ว่ามีปริมาตร 22.4 dm 3 จ) ในการนับอนุภาค แต่ละองค์ประกอบจะเท่ากันและรับค่า 6.022·10 23 
เปอร์เซ็นต์ผลผลิตของปฏิกิริยาเคมี [ %W]
การคำนวณปริมาณสัมพันธ์ยังใช้เพื่อหาผลผลิตของปฏิกิริยา เช่น อัตราส่วนของปริมาณจริงของผลิตภัณฑ์ที่ได้รับกับปริมาณที่ได้มาจากสมการปฏิกิริยาเคมี
ตัวอย่างที่ 1
ทำปฏิกิริยาออกซิเดชันของซัลเฟอร์ (IV) ออกไซด์ 30 กิโลกรัม และเมื่อมีตัวเร่งปฏิกิริยาแพลตตินัม ผลลัพธ์ที่ได้คือ ซัลเฟอร์ (VI) ออกไซด์ 34 กิโลกรัม ผลลัพธ์ของกระบวนการนี้คืออะไร? สมการปฏิกิริยาเคมี: ![]() จากปฏิกิริยาที่บันทึกไว้ เราจะเห็นว่าซัลเฟอร์ (IV) ออกไซด์สองโมลผลิตซัลเฟอร์ (VI) ออกไซด์ในปริมาณเท่ากัน เมื่อทราบมวลโมลาร์ของสารตั้งต้น เรารู้ว่าปริมาณสัมพันธ์ โดยสมมติว่าให้ผลผลิต 100%, 128 กรัม SO 2 จะให้ 160 กรัม SO 3 ด้วยความรู้นี้ เราสามารถจัดอัตราส่วนได้: 0.128 กก. SO 2 – 0.160 กก. SO 3 30 กก. SO 2 – x กก. SO 3 จากที่นี่ เราจะหาปริมาณซัลเฟอร์ (VI) ออกไซด์ที่จะผลิตได้ที่ร้อยละ 100 ผลผลิต.
จากปฏิกิริยาที่บันทึกไว้ เราจะเห็นว่าซัลเฟอร์ (IV) ออกไซด์สองโมลผลิตซัลเฟอร์ (VI) ออกไซด์ในปริมาณเท่ากัน เมื่อทราบมวลโมลาร์ของสารตั้งต้น เรารู้ว่าปริมาณสัมพันธ์ โดยสมมติว่าให้ผลผลิต 100%, 128 กรัม SO 2 จะให้ 160 กรัม SO 3 ด้วยความรู้นี้ เราสามารถจัดอัตราส่วนได้: 0.128 กก. SO 2 – 0.160 กก. SO 3 30 กก. SO 2 – x กก. SO 3 จากที่นี่ เราจะหาปริมาณซัลเฟอร์ (VI) ออกไซด์ที่จะผลิตได้ที่ร้อยละ 100 ผลผลิต. 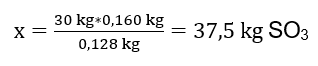 เมื่อทราบปริมาณทางทฤษฎีและตามจริงของ SO 3 เราสามารถคำนวณผลผลิตที่เกิดปฏิกิริยาได้ 37.5 กก. SO 3 – ผลผลิต 100%34 กก. SO 3 – ผลผลิต x%
เมื่อทราบปริมาณทางทฤษฎีและตามจริงของ SO 3 เราสามารถคำนวณผลผลิตที่เกิดปฏิกิริยาได้ 37.5 กก. SO 3 – ผลผลิต 100%34 กก. SO 3 – ผลผลิต x%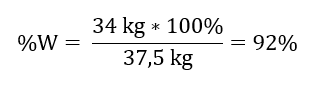 การเกิดออกซิเดชันของซัลเฟอร์ (IV) ออกไซด์เป็นซัลเฟอร์ (VI) ออกไซด์โดยใช้ตัวเร่งปฏิกิริยาแพลตตินัมเกิดขึ้นที่ผลผลิต 92%
การเกิดออกซิเดชันของซัลเฟอร์ (IV) ออกไซด์เป็นซัลเฟอร์ (VI) ออกไซด์โดยใช้ตัวเร่งปฏิกิริยาแพลตตินัมเกิดขึ้นที่ผลผลิต 92%
สูตรโมเลกุลและองค์ประกอบ
การประยุกต์ใช้การคำนวณปริมาณสัมพันธ์อีกวิธีหนึ่งคือการกำหนดสูตรของสารประกอบเคมีอย่างง่าย สูตรโมเลกุลของสารประกอบเคมีเหมือนกันหรือเป็นจำนวนเต็มเท่าของสูตรเชิงประจักษ์ หากเรารู้ว่าสูตรทั่วไปของสารประกอบเคมีคือ N x O y ค่าของดัชนีปริมาณสัมพันธ์สามารถคำนวณได้โดยการหารมวลต่ออะตอมด้วยมวลอะตอมของพวกมัน ถ้าไม่ทราบน้ำหนักโมเลกุลของสารประกอบเคมี แต่ทราบเฉพาะองค์ประกอบเป็นเปอร์เซ็นต์ ก็จะให้เฉพาะสูตรธาตุเท่านั้น อาจเป็นตัวแทนที่แท้จริงของสูตรโมเลกุลหรือเพียงกำหนดอัตราส่วนของแต่ละองค์ประกอบเท่านั้น
ตัวอย่างที่ 1
น้ำหนักโมเลกุลของสารประกอบเคมีคือ 92 u และประกอบด้วยไนโตรเจน 30.43%และออกซิเจน 69.57%สารประกอบเคมีมีสูตรโมเลกุลข้อใด เนื่องจากผลรวมของโมเลกุลที่มีอยู่ในสารประกอบคือ 100%เราจึงสามารถสรุปได้ว่า: 92 u – 100%สิ่งนี้ทำให้เราสามารถคำนวณปริมาณธาตุแต่ละรายการได้: 92 u – 100%xu ของไนโตรเจน – 30.43%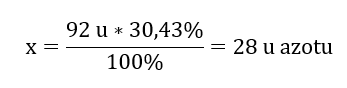 ดังนั้นเราจึงรู้ว่ามวลต่ออะตอมของออกซิเจนคือ: 92 u – 28 u = 64 u เมื่อทราบมวลของธาตุแต่ละธาตุ เราก็สามารถกำหนดดัชนีปริมาณสัมพันธ์ได้:
ดังนั้นเราจึงรู้ว่ามวลต่ออะตอมของออกซิเจนคือ: 92 u – 28 u = 64 u เมื่อทราบมวลของธาตุแต่ละธาตุ เราก็สามารถกำหนดดัชนีปริมาณสัมพันธ์ได้: 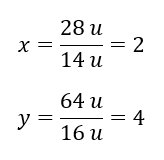 สูตรโมเลกุลของสารประกอบเคมีนี้คือ N 2 O 4 .
สูตรโมเลกุลของสารประกอบเคมีนี้คือ N 2 O 4 .
ตัวอย่างที่ 2
สารประกอบทางเคมีมีสององค์ประกอบ – ออกซิเจนที่ 60%และกำมะถัน 40%สูตรธาตุของมันคืออะไร? สูตรทั่วไปคือ S x O y โดยที่ x คือ 40%และ y คือ 60%เมื่อทราบมวลโมลาร์ของธาตุแต่ละธาตุแล้ว จึงสามารถแสดงได้ดังนี้ 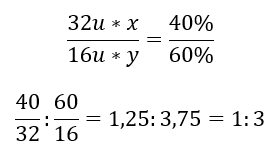 ซึ่งหมายความว่าในสารประกอบทางเคมีที่กำหนด มีอะตอมออกซิเจนสามอะตอมสำหรับอะตอมกำมะถันหนึ่งอะตอม สูตรองค์ประกอบคือ SO 3
ซึ่งหมายความว่าในสารประกอบทางเคมีที่กำหนด มีอะตอมออกซิเจนสามอะตอมสำหรับอะตอมกำมะถันหนึ่งอะตอม สูตรองค์ประกอบคือ SO 3 
วัสดุพิมพ์ส่วนเกินและจำกัด
ในกรณีของปฏิกิริยาซึ่งมีสารตั้งต้นอยู่ในอัตราส่วนที่แตกต่างจากปริมาณสัมพันธ์ที่สอดคล้องกัน สารตั้งต้นตัวใดตัวหนึ่งจะทำปฏิกิริยาอย่างสมบูรณ์และปฏิกิริยาจะหยุดลง จากนั้นจะปรากฏอยู่ในรูปของสารตั้งต้นจำกัด ในขณะที่สารตั้งต้นตัวที่สองจะอยู่ในระบบมากเกินไปและจะยังคงอยู่ในระบบในรูปแบบหลักเมื่อปฏิกิริยาเสร็จสมบูรณ์
ตัวอย่างที่ 1
ในห้องปฏิบัติการ สารละลายอะลูมิเนียมซัลเฟต 0.25 โมลาร์ 40 ซม. 3 ทำปฏิกิริยากับสารละลายแบเรียมคลอไรด์ 0.5 โมลาร์ 50 ซม. 3 จะเกิดตะกอนกี่กรัม? สมการปฏิกิริยาเคมี: ![]() ขั้นตอนแรกในการทราบทิศทางที่แท้จริงของปฏิกิริยาคือการกำหนดจำนวนโมลที่แท้จริงของสารที่เกี่ยวข้องกับปฏิกิริยา n Al2(SO4)2 : C Al2(SO4)2 · V Al2(SO4)2 = 0.25 · 0.04 dm 3 = 0.010 mol n BaCl2 : C BaCl2 · V BaCl2 = 0.5 · 0.05 dm 3 = 0.025 mol ขั้นตอนที่สองคือ เพื่อกำหนดสารตั้งต้นที่ขาดดุลตามปริมาณสัมพันธ์ของปฏิกิริยา – สิ่งนี้จะกำหนดปริมาณของการตกตะกอนที่เกิดขึ้น 1 โมล อัล 2 (SO 4 ) 3 – 3 โมล BaCl 2 0.010 โมล อัล 2 (SO 4 ) 3 – x โมล BaCl 2
ขั้นตอนแรกในการทราบทิศทางที่แท้จริงของปฏิกิริยาคือการกำหนดจำนวนโมลที่แท้จริงของสารที่เกี่ยวข้องกับปฏิกิริยา n Al2(SO4)2 : C Al2(SO4)2 · V Al2(SO4)2 = 0.25 · 0.04 dm 3 = 0.010 mol n BaCl2 : C BaCl2 · V BaCl2 = 0.5 · 0.05 dm 3 = 0.025 mol ขั้นตอนที่สองคือ เพื่อกำหนดสารตั้งต้นที่ขาดดุลตามปริมาณสัมพันธ์ของปฏิกิริยา – สิ่งนี้จะกำหนดปริมาณของการตกตะกอนที่เกิดขึ้น 1 โมล อัล 2 (SO 4 ) 3 – 3 โมล BaCl 2 0.010 โมล อัล 2 (SO 4 ) 3 – x โมล BaCl 2 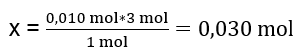 เพื่อให้เกิดปฏิกิริยาได้อย่างสมบูรณ์ โดยมี 0.010mol Al 2 (SO 4 ) 3 จำเป็นต้องเติม BaCl 2 0.030mol เข้าสู่ระบบ อย่างไรก็ตาม แบเรียมคลอไรด์เพียง 0.025 โมลที่ทำปฏิกิริยา ซึ่งหมายความว่าอยู่ในภาวะขาดดุลและจะจำกัดปฏิกิริยา ดังนั้นควรคำนวณปริมาณตะกอนที่เกิดขึ้นในปฏิกิริยาจากปริมาณของสารตั้งต้นนี้ จำนวนโมลของแบเรียมคลอไรด์ที่ใช้ตามปริมาณสัมพันธ์ของปฏิกิริยาจะเท่ากับจำนวนโมลของตะกอนที่เกิดขึ้น ดังนั้น: n BaSO4 = n BaCl2 0.025mol BaSO 4 = 0.025mol BaCl 2 รู้จำนวนโมลของแบเรียม ซัลเฟต เราสามารถคำนวณมวลของมันได้: m BaSO4 = n BaSO4 · M BaSO4 m BaSO4 = 0.025mol · 233.393 g/mol = 5.835g ปฏิกิริยาและปริมาณของซับสเตรตที่ให้ในงานทำให้เกิดตะกอนแบเรียมซัลเฟต 5.835 กรัม
เพื่อให้เกิดปฏิกิริยาได้อย่างสมบูรณ์ โดยมี 0.010mol Al 2 (SO 4 ) 3 จำเป็นต้องเติม BaCl 2 0.030mol เข้าสู่ระบบ อย่างไรก็ตาม แบเรียมคลอไรด์เพียง 0.025 โมลที่ทำปฏิกิริยา ซึ่งหมายความว่าอยู่ในภาวะขาดดุลและจะจำกัดปฏิกิริยา ดังนั้นควรคำนวณปริมาณตะกอนที่เกิดขึ้นในปฏิกิริยาจากปริมาณของสารตั้งต้นนี้ จำนวนโมลของแบเรียมคลอไรด์ที่ใช้ตามปริมาณสัมพันธ์ของปฏิกิริยาจะเท่ากับจำนวนโมลของตะกอนที่เกิดขึ้น ดังนั้น: n BaSO4 = n BaCl2 0.025mol BaSO 4 = 0.025mol BaCl 2 รู้จำนวนโมลของแบเรียม ซัลเฟต เราสามารถคำนวณมวลของมันได้: m BaSO4 = n BaSO4 · M BaSO4 m BaSO4 = 0.025mol · 233.393 g/mol = 5.835g ปฏิกิริยาและปริมาณของซับสเตรตที่ให้ในงานทำให้เกิดตะกอนแบเรียมซัลเฟต 5.835 กรัม
