พลังงานของปฏิกิริยาเคมีเป็นหนึ่งในองค์ประกอบสำคัญที่ช่วยให้เราเข้าใจการเปลี่ยนแปลงที่เกิดขึ้นในปฏิกิริยาเคมี ในระหว่างการเปลี่ยนแปลงดังกล่าว สารประกอบทางเคมีจะถูกผลิตขึ้นโดยมีโครงสร้างและองค์ประกอบทางเคมีที่แตกต่างจากวัตถุดิบที่ผลิตขึ้น ในระหว่างปฏิกิริยาเคมี พันธะที่มีอยู่ระหว่างอะตอมของโมเลกุลที่ใช้เป็นสารตั้งต้นจะถูกหักออกและเกิดพันธะใหม่ขึ้น ซึ่งมีอยู่ในผลิตภัณฑ์

ระบบและสิ่งแวดล้อมของปฏิกิริยาเคมี
สำหรับการตีความปฏิกิริยาเคมีในแง่ของพลังงานอย่างถูกต้อง เราจำเป็นต้องมีความรู้เกี่ยวกับสิ่งต่อไปนี้:
- ระบบ: พื้นที่แยกของสสารที่มีขอบเขตชัดเจน ประเภทของระบบมีความสำคัญ: เปิดหากปฏิกิริยาเกี่ยวข้องกับการแลกเปลี่ยนพลังงานและสสาร ปิดหากปฏิกิริยาเกี่ยวข้องกับการแลกเปลี่ยนพลังงานเท่านั้น หรือแยกออกหากไม่มีการแลกเปลี่ยนพลังงานหรือสสาร
- สภาพแวดล้อม: สิ่งใดก็ตามที่ไม่ได้รวมอยู่ในระบบแต่อยู่ในบริเวณใกล้เคียง
- ส่วนประกอบของระบบ: สารทั้งหมดที่อยู่ในระบบที่วิเคราะห์และมีคุณสมบัติทางเคมีเฉพาะ
พลังงานของพันธะเคมี
ผลกระทบด้านพลังงานที่เป็นลักษณะเฉพาะของปฏิกิริยาเคมีเป็นผลมาจากการเปลี่ยนแปลงที่เกิดขึ้นในขณะที่แตกออกและสร้างพันธะใหม่ระหว่างอะตอม ความจริงก็คือการแตกของพันธะเคมีแต่ละครั้งมีความเชื่อมโยงภายในกับการดูดซับพลังงานในปริมาณที่เหมาะสม ในขณะที่การก่อตัวของพันธะใหม่ทำให้เกิดการผลิตพลังงาน การปล่อยพลังงานสู่สิ่งแวดล้อมอาจมีผลกระทบต่างๆ กัน เช่น ความร้อน แสงสว่าง งาน หรือไฟฟ้า แต่ละกระบวนการเหล่านี้เป็นปัจจัยองค์ประกอบที่ส่งผลต่อการเปลี่ยนแปลงทั่วไปในพลังงานภายในของระบบที่เกิดปฏิกิริยาขึ้น สิ่งสำคัญคือ ไม่ว่ารีเอเจนต์จะต้องดึงหรือสูญเสียพลังงานในระหว่างการเปลี่ยนแปลงก็ตาม จำเป็นต้องใช้พลังงานจำนวนหนึ่งเพื่อเริ่มต้นกระบวนการทั้งหมดเสมอ
กฎข้อที่หนึ่งของอุณหพลศาสตร์
กฎสำคัญข้อแรกเกี่ยวกับพลังงานของปฏิกิริยาเคมีคือความสัมพันธ์ที่กำหนดขึ้นในกฎข้อที่หนึ่งของอุณหพลศาสตร์ ซึ่งระบุว่าพลังงานภายในของระบบซึ่งแลกเปลี่ยนพลังงานกับสิ่งแวดล้อมเท่านั้น (ระบบปิด) เท่านั้นที่สามารถเปลี่ยนเป็นความร้อนหรืองานได้ สิ่งนี้สะท้อนให้เห็นในสมการของเฮล์มโฮลทซ์: ∆U = Q + W โดยที่ ΔU หมายถึงการเปลี่ยนแปลงของพลังงานภายใน Q หมายถึงความร้อน และ W หมายถึงงาน เราสามารถสังเกตได้จากสูตรว่าพลังงานภายในของระบบที่แยกออกมา เช่น ระบบที่ไม่มีการแลกเปลี่ยนพลังงานหรือมวลกับสิ่งแวดล้อมนั้นมีค่าคงที่ ส่วนประกอบของพลังงานภายใน ได้แก่ พลังงานจลน์ทั้งหมดของอะตอม ไอออน โมเลกุล อิเล็กตรอน และส่วนประกอบของนิวเคลียสของอะตอม ซึ่งขณะนี้อยู่ในระบบปฏิกิริยา ตลอดจนพลังงานของอันตรกิริยาซึ่งได้แก่ พลังงานของพันธะเคมี อันตรกิริยา ระหว่างค่าใช้จ่าย และอื่นๆ โปรดทราบว่าพลังงานภายในไม่มีพลังงานจลน์หรือพลังงานศักย์ของระบบโดยรวม ผลรวมของพลังงานจลน์และพลังงานศักย์ของระบบโดยรวมและพลังงานภายในคือพลังงานทั้งหมดของระบบ (E)
เอนทาลปีของระบบ (H)
นี่เป็นแนวคิดสำคัญอีกประการหนึ่งที่เกี่ยวข้องกับพลังงานของปฏิกิริยาเคมี ซึ่งในทางปฏิบัติหมายถึงผลรวมของพลังงานภายในของระบบและผลคูณของความดันและปริมาตร ในเชิงคุณภาพ มันคือพลังงานที่ต้องใช้ในการผลิตระบบในสุญญากาศ (U) เพิ่มขึ้นตามงาน นั่นคือผลหารของความดันและปริมาตร (pV) ซึ่งระบบต้องดำเนินการกับแรงภายนอกเพื่อให้ได้ปริมาตรที่แตกต่างจาก ศูนย์. ความสัมพันธ์ที่กำหนดเอนทัลปีของระบบแสดงไว้ดังนี้: H = U + pV ปฏิกิริยาที่เกิดขึ้นในระบบดังกล่าวทำให้เกิดการเปลี่ยนแปลงเล็กน้อยในเอนทัลปี: dH = dU + dpV + pdV หากสภาวะการเกิดปฏิกิริยาเป็นแบบไอโซบาริก ดังนั้น หากความดันระหว่าง กระบวนการไม่เปลี่ยนแปลง สามารถละส่วนที่สองได้ เนื่องจาก dpV=0 หลังจากแทนส่วนต่างสำหรับการเพิ่มขึ้นที่แน่นอนและหลังจากแทนที่นิพจน์ที่อ้างถึงการเปลี่ยนแปลงของพลังงานภายในระบบ เราได้ความสัมพันธ์ต่อไปนี้: ∆H = Q + W + p∆V สมมติว่ากระบวนการวิเคราะห์ทำงานเชิงปริมาตรที่ความดันคงที่ แล้ว W = -pΔV และดังนั้น: ∆H = Q – p∆V + p∆V จากสมการที่ว่าหากปฏิกิริยาเกิดขึ้นที่ความดันคงที่ การเปลี่ยนแปลงของเอนทาลปีของระบบจะเท่ากับความร้อน: ∆H = Q
พลังของปฏิกิริยา
ตามสูตรที่ได้รับข้างต้น ซึ่งบ่งชี้ว่าการเปลี่ยนแปลงของเอนทัลปีของระบบอาจเท่ากับความร้อนของปฏิกิริยา กระบวนการต่างๆ จะถูกจัดประเภทตามการแปลงทางความร้อน ในแง่ของทิศทางการไหลของพลังงาน เราแบ่งปฏิกิริยาเคมีออกเป็น:
- ปฏิกิริยาคายความร้อน ซึ่งเป็นปฏิกิริยาที่เราสามารถสังเกตการปลดปล่อยพลังงาน เช่น ในรูปของความร้อน สู่สภาพแวดล้อมของระบบ สิ่งนี้เกิดขึ้นเมื่อผลรวมของเอนทาลปีของผลิตภัณฑ์ต่ำกว่าผลรวมของเอนทาลปีของสารตั้งต้น ดังนั้นเมื่อ ΔH<0
- ปฏิกิริยาดูดความร้อน เช่น ปฏิกิริยาเคมีที่ทำให้เกิดการดูดกลืนพลังงานจากสิ่งแวดล้อม เงื่อนไขสำหรับปฏิกิริยาดังกล่าวคือการส่งพลังงานในปริมาณที่เหมาะสม สิ่งนี้ใช้กับการแปลงทั้งหมดที่เอนทาลปีรวมของผลิตภัณฑ์สูงกว่าเอนทาลปีทั้งหมดของซับสเตรต ดังนั้น ΔH>0
สัญลักษณ์ของปฏิกิริยาเคมี
เมื่อพิจารณาปฏิกิริยาเคมีพร้อมกับความต้องการและการกระจายพลังงาน ผลกระทบจากความร้อนจำเพาะจะรวมอยู่ในสัญลักษณ์ของสมการเคมี สำหรับปฏิกิริยาคายความร้อน ค่าสัมบูรณ์ของผลกระทบจากความร้อนที่มีอยู่จะระบุไว้ที่ด้านผลิตภัณฑ์ ในทางกลับกัน เมื่อสังเกตปฏิกิริยาการดูดความร้อน ค่าสัมบูรณ์ของพลังงานที่ดูดซับจะสังเกตได้ที่ด้านซับสเตรต เพื่อยกตัวอย่าง:
- ปฏิกิริยาคายความร้อน:
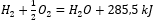
- ปฏิกิริยาดูดความร้อน: 2H 3 PO 4 + 3Mg(OH) 2 + 407kJ = Mg 3 (PO 4 ) 2 + 6H 2 O
อีกวิธีหนึ่งคือการจดสมการเคมีพร้อมกับค่าเอฟเฟกต์พลังงานที่เว้นไว้ ในกรณีนี้ ค่าที่แสดงถึงพลังงานของปฏิกิริยาจากพลังงานภายนอกจะเป็นค่าลบ ในขณะที่ค่าที่แสดงถึงพลังงานของปฏิกิริยาจากพลังงานภายนอกจะเป็นค่าบวก ตัวอย่างเช่น:
- ปฏิกิริยาจากพลังงานภายนอก: Fe + S → FeS ∆H= -95,2 kJ/mol
- ปฏิกิริยาเอนโดเอเนอร์จิก: FeS → Fe + S ∆H= 95,2 kJ/mol
กฎของเฮสส์
เป็นรากฐานสำหรับการคำนวณทางความร้อนเคมี โดยระบุว่าผลกระทบจากความร้อนจะเหมือนกันเสมอโดยไม่คำนึงถึงวิธีการดำเนินการของปฏิกิริยา สิ่งนี้ทำให้เราสามารถคำนวณเอนทัลปีมาตรฐานของปฏิกิริยา (Δ r H ϴ ) โดยสมมติว่าใช้สภาวะมาตรฐาน นั่นคือความดัน 10 5 Pa และอุณหภูมิใดๆ เนื่องจากเอนทาลปีเป็นฟังก์ชันของสถานะ ความแปรปรวนจึงขึ้นอยู่กับค่าเพียงสองค่าเท่านั้น: ในสถานะเริ่มต้นและสถานะสุดท้าย ซึ่งในปฏิกิริยาเคมีแสดงถึงสถานะของสารตั้งต้นและสถานะของผลิตภัณฑ์ตามลำดับ กฎของเฮสส์แสดงโดยสมการที่ประกอบด้วยสัมประสิทธิ์สตีชิโอเมตริก (v) และเอนทัลปีของฟันกรามมาตรฐานของการก่อตัว (Δ f H ϴ ): 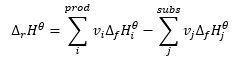
เอนทัลปีฟันกรามมาตรฐานของการก่อตัว
เป็นเอนทัลปีที่ได้จากการสร้างสารประกอบทางเคมีเฉพาะ 1 โมลจากธาตุในสถานะพื้นฐาน สถานะพื้นฐานคือตัวแปรที่ทนทานที่สุดขององค์ประกอบในสภาวะเฉพาะ ตัวอย่างเช่น กราไฟต์ เป็น คาร์บอน ที่ทนทานที่สุดที่อุณหภูมิ 25 o C และ 10 5 Pa ในทางกลับกัน ที่อุณหภูมิและความดันสูง คาร์บอนในรูปแบบที่เสถียรคือเพชร สำหรับสารตั้งต้นแต่ละตัวที่เข้าร่วมในปฏิกิริยาในสภาวะพื้นฐาน ค่าของเอนทาลปีของโมลาร์มาตรฐานของการก่อตัวเป็นศูนย์ โดยปกติแล้วสิ่งเหล่านี้คืออะตอมเดี่ยวของ ก๊าซมีตระกูลหรือก๊าซชนิด อื่นที่ทนทานที่สุดในสภาวะเฉพาะ สำหรับความดันมาตรฐาน (10 5 Pa) และอุณหภูมิ (ปกติ 25 o C) ค่าของเอนทัลปีของโมลาร์มาตรฐานของการก่อตัวของสารประกอบจะรวบรวมไว้ในตารางเคมี หน่วยของค่านั้นคือ กฎของเฮสส์ที่ใช้กับปฏิกิริยาเคมีหมายความว่าค่าเอนทาลปีของปฏิกิริยาไม่ขึ้นอยู่กับจำนวนของปฏิกิริยาระหว่างกลาง ข้อมูลสำคัญเพียงอย่างเดียวคือมีการใช้วัสดุพิมพ์เฉพาะเพื่อให้ได้ผลิตภัณฑ์เฉพาะ
การสังเคราะห์คาร์บอนไดออกไซด์
การสังเคราะห์คาร์บอนไดออกไซด์สามารถดำเนินการได้หลายวิธี แต่ตามกฎของ Hess แต่ละข้อนำไปสู่การเปลี่ยนแปลงค่าเอนทาลปีมาตรฐานที่เท่ากัน
- การสังเคราะห์โดยตรง
- การสังเคราะห์คาร์บอน (II) ออกไซด์ + ออกซิเดชันของสารประกอบเป็นคาร์บอน (IV) ออกไซด์
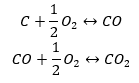 เมื่อเราอ่านค่าเอนทาลปีมาตรฐานของการก่อตัวของสารประกอบจากตารางและแทนค่าเหล่านี้ในสมการเคมี เราจะเห็นว่าค่าเอนทาลปีสำหรับแต่ละวิธีเท่ากัน: -393.5 กิโลจูลต่อโมล
เมื่อเราอ่านค่าเอนทาลปีมาตรฐานของการก่อตัวของสารประกอบจากตารางและแทนค่าเหล่านี้ในสมการเคมี เราจะเห็นว่าค่าเอนทาลปีสำหรับแต่ละวิธีเท่ากัน: -393.5 กิโลจูลต่อโมล
กฎของเคอร์ชอฟฟ์
ช่วยให้เราสามารถแปลงการคำนวณเพื่อคำนวณค่าเอนทาลปีมาตรฐานของปฏิกิริยาสำหรับอุณหภูมิหนึ่งๆ ถ้าเราทราบค่าของมันที่อุณหภูมิอื่น เรายังทราบความสัมพันธ์ระหว่างความร้อนโมลาร์ของสารตั้งต้นทั้งหมดและอุณหภูมิ สามารถใช้กฎหมายได้เนื่องจากการเปลี่ยนแปลงของเอนทาลปีของปฏิกิริยาขึ้นอยู่กับสภาวะที่ถูกกำหนด: มันแปรผันตามอุณหภูมิและความดันที่เปลี่ยนแปลง ที่มาของสูตรควรเริ่มต้นด้วยการกำหนดความจุความร้อน นั่นคืออัตราส่วนของความร้อนที่ป้อนให้กับอุณหภูมิที่เพิ่มขึ้น: ![]() สมมติว่ามีสภาวะอุณหภูมิความร้อน เราสามารถทำการเปลี่ยนแปลงต่อไปนี้:
สมมติว่ามีสภาวะอุณหภูมิความร้อน เราสามารถทำการเปลี่ยนแปลงต่อไปนี้: ![]() การรวมสมการผลลัพธ์และการแปลงค่าความจุความร้อนเป็นส่วนที่แสดงถึงการเปลี่ยนแปลงความจุความร้อนมาตรฐานสะท้อนให้เห็นโดยสมการที่ให้ไว้ในกฎของเคอร์ชอฟฟ์:
การรวมสมการผลลัพธ์และการแปลงค่าความจุความร้อนเป็นส่วนที่แสดงถึงการเปลี่ยนแปลงความจุความร้อนมาตรฐานสะท้อนให้เห็นโดยสมการที่ให้ไว้ในกฎของเคอร์ชอฟฟ์: 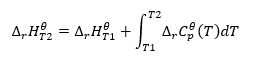 สำหรับสภาวะมาตรฐาน การเปลี่ยนแปลงความจุความร้อนของปฏิกิริยาถูกกำหนดโดยสมการที่มีตัวแปร v ซึ่งเป็นปัจจัยทางสตีคิโอเมตริก และ ซึ่งแสดงถึงความร้อนโมลาร์มาตรฐานของสารตั้งต้นที่กำหนด เมื่อความแตกต่างของอุณหภูมิมีขนาดเล็ก (สูงถึง 100K) ค่าของความร้อนโมลาร์มาตรฐานของสารตั้งต้นจะถือว่าคงที่ภายในช่วงที่กำหนด จากนั้นเราสามารถใช้รูปแบบอย่างง่ายของกฎของเคอร์ชอฟฟ์ โดยสมมติว่าความจุทางความร้อนของสารตั้งต้นไม่ได้ขึ้นอยู่กับอุณหภูมิ แต่ขึ้นกับความดันคงที่ :
สำหรับสภาวะมาตรฐาน การเปลี่ยนแปลงความจุความร้อนของปฏิกิริยาถูกกำหนดโดยสมการที่มีตัวแปร v ซึ่งเป็นปัจจัยทางสตีคิโอเมตริก และ ซึ่งแสดงถึงความร้อนโมลาร์มาตรฐานของสารตั้งต้นที่กำหนด เมื่อความแตกต่างของอุณหภูมิมีขนาดเล็ก (สูงถึง 100K) ค่าของความร้อนโมลาร์มาตรฐานของสารตั้งต้นจะถือว่าคงที่ภายในช่วงที่กำหนด จากนั้นเราสามารถใช้รูปแบบอย่างง่ายของกฎของเคอร์ชอฟฟ์ โดยสมมติว่าความจุทางความร้อนของสารตั้งต้นไม่ได้ขึ้นอยู่กับอุณหภูมิ แต่ขึ้นกับความดันคงที่ : ![]()
























































































































