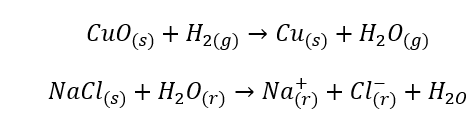การพิจารณาปรากฏการณ์และกระบวนการต่าง ๆ จะต้องมีหลายชั้น เราควรคำนึงถึงคุณสมบัติทั้งในระดับจุลภาคและระดับมหภาค ตามชื่อที่แนะนำ การแบ่งนี้เกิดจากการแยกลำดับความสำคัญของรายการที่วิเคราะห์ โดเมนระดับมหภาคซึ่งเชื่อมโยงอย่างใกล้ชิดกับอุณหพลศาสตร์ของปฏิกิริยาเคมี ช่วยให้เราสามารถสังเกตและวัดคุณสมบัติทางกายภาพและทางเคมี เช่น ความหนาแน่น อุณหภูมิ หรือความสามารถในการละลายได้ ด้วยการวิเคราะห์ด้วยกล้องจุลทรรศน์ เราสามารถสังเกตการเคลื่อนไหวและปฏิสัมพันธ์ของโมเลกุลได้ เราสามารถอธิบายโมเลกุลในแง่ของความเร็วและพลังงานจลน์ได้ หากเราสนใจในส่วนผสม เราอาจพิจารณาถึงความเป็นเนื้อเดียวกันและประเภทของระบบที่มีอยู่

การจำแนกระบบเคมีฟิสิกส์
เมื่อวิเคราะห์ความเป็นเนื้อเดียวกันของระบบวัสดุ มาตราส่วนมาโครจะจำแนกพวกมันออกเป็นสองกลุ่มหลัก: ระบบที่เป็นเนื้อเดียวกันและต่างกัน การจัดหมวดหมู่นี้แบ่งตามลักษณะทางกายภาพ ได้แก่ สถานะทางกายภาพ ความสามารถในการละลาย และจุดหลอมเหลว ซึ่งอาจแตกต่างกันหรือไม่ก็ได้ ทุกระบบรวมถึงสารทั้งหมดที่มีส่วนร่วมในปฏิกิริยาหรือกระบวนการเฉพาะ ส่วนของระบบที่โดดเด่นอย่างชัดเจนโดยการรักษาคุณสมบัติเดียวกันเรียกว่าเฟส มีเฟสที่แตกต่างกันสามประเภท: ของแข็ง ของเหลว และแก๊ส พื้นผิวที่อยู่ระหว่างพวกเขากับส่วนที่เหลือของระบบเรียกว่าส่วนต่อประสาน ขึ้นอยู่กับเอนทัลปีอิสระ (ΔG) หรือเอนโทรปี (ΔS) ถ้า ΔS>0 หรือ ΔG<0 การเปลี่ยนแปลงของเฟสหนึ่งไปสู่อีกเฟสหนึ่งอาจเกิดขึ้นโดยอัตโนมัติ
แผนภาพสมดุลเฟส
การแสดงกราฟิกของการมีอยู่ของเฟสต่างๆ เรียกว่า แผนภาพสมดุลเฟส ซึ่งรวมถึงการมีอยู่ของเฟสเฉพาะ (หากถึงช่วงอุณหภูมิและความดันที่กำหนด) และการแปลงร่วมกัน แผนภาพสมดุลเฟสแบบแผนสำหรับระบบที่มีส่วนประกอบเดียวแสดงให้เห็นถึงการมีอยู่ของเฟสหลักสามเฟสขึ้นอยู่กับเงื่อนไขของกระบวนการ เส้นที่แสดงนั้นบ่งบอกถึงสภาวะสมดุลระหว่างสองเฟสตามลำดับ นั่นคือระหว่างของแข็งกับแก๊ส ระหว่างของแข็งกับของเหลว และระหว่างแก๊สกับของเหลว ดังนั้น หากเราทราบหนึ่งในพารามิเตอร์ที่สำคัญ เราจะสามารถระบุสภาวะที่จะทำให้เกิดการหลอมเหลว การแช่แข็ง การระเหย การควบแน่น การระเหิด หรือการระเหิดซ้ำของส่วนผสมที่เป็นปัญหา นอกจากนี้ แผนภาพยังมีจุดสามจุดที่เส้นเฟสทั้งหมดเชื่อมต่อกัน ซึ่งบ่งชี้ว่าทั้งสามเฟสสามารถอยู่ร่วมกันได้ในสภาวะที่ระบุ แผนภาพยังมีจุดสำคัญสองจุด ได้แก่ ความดันวิกฤตและอุณหภูมิวิกฤต ความดันวิกฤตจะแสดงโดยจุดที่แสดงถึงความดันสูงสุดที่เราสามารถเปลี่ยนของเหลวเป็นแก๊สได้ หรือความดันสูงสุดของไออิ่มตัวเหนือของเหลว แนวคิดของอุณหภูมิวิกฤตกำหนดอุณหภูมิสูงสุดที่ก๊าซสามารถควบแน่นได้เมื่อความดันเพิ่มขึ้น ดังนั้น จุดวิกฤตที่อุณหภูมิวิกฤตและสภาวะความดันวิกฤตจึงกำหนดสถานะที่เฟสของเหลวและก๊าซไม่สามารถแยกความแตกต่างได้
กฎของเฟส Gibbs
เป็นความสัมพันธ์เฉพาะที่สามารถใช้ได้กับระบบใดๆ ที่มีอยู่ในสมดุลทางอุณหพลศาสตร์ สมการที่แสดงกฎนั้นมีจำนวนเฟส (f) ที่มีอยู่ในระบบพร้อมจำนวนองค์ประกอบอิสระ (n) และจำนวนองศาอิสระ (s) หมายเลข s สอดคล้องกับปริมาณของตัวแปรเข้มข้นที่ปรับได้ซึ่งหากมีการเปลี่ยนแปลง จะไม่รบกวนจำนวนเฟสในสมดุลของระบบแยก ตัวแปรเร่งรัดคือค่าทางกายภาพใดๆ ที่ไม่ได้ขึ้นอยู่กับระบบ (เช่น ขนาดหรือปริมาตรทางเรขาคณิต) หรือจำนวนโมเลกุล น้ำหนัก ความร้อนจำเพาะ ฯลฯ สมการมีดังนี้ ส่วนประกอบอิสระของระบบ กำหนดให้เป็น n ซึ่งแสดงถึงจำนวนส่วนประกอบระบบที่ต่ำที่สุดที่จำเป็นในการสร้างแต่ละเฟสในปริมาณเท่าใดก็ได้ หากเราวิเคราะห์ระบบที่ส่วนประกอบอาจทำปฏิกิริยากันเอง เราจะคำนวณค่า n โดยลบจำนวนสมการปฏิกิริยาอิสระออกจากจำนวนส่วนประกอบทั้งหมดที่สร้างระบบ ดังนั้น หากเราถือว่าสัญกรณ์ต่อไปนี้: ![]() จำนวนสมการอิสระคือ 1 – เราตรวจสอบปฏิกิริยาเฉพาะที่เกิดขึ้นในระบบ สมการอิสระคือระบบสมการเคมีใด ๆ ที่ไม่สามารถได้มาซึ่งสมการใด ๆ จากการรวมสมการอื่น ๆ ในขณะที่จำนวนของส่วนประกอบสำหรับระบบดังกล่าวคือ 3: พวกมันคือ CaCO 3 , CaO และ CO 2 ข้อมูลนี้ยังช่วยให้เราสามารถคำนวณจำนวนองค์ประกอบอิสระ: n = จำนวนองค์ประกอบ – จำนวนสมการอิสระ ดังนั้น: n = 3 – 1 = 2 เราสามารถใช้ตัวอย่างเดียวกันนี้ในการคำนวณจำนวนองศาอิสระ โดยใช้สมการของกฎเฟสกิ๊บส์: s = n – f + 2 = 2 – 3 + 2 = 1 ค่านี้บ่งชี้ว่าเพื่อรักษาปริมาณเฟสให้คงที่ในสภาวะสมดุลของระบบ เราสามารถใช้ตัวแปรเข้มข้นได้เพียงตัวเดียว
จำนวนสมการอิสระคือ 1 – เราตรวจสอบปฏิกิริยาเฉพาะที่เกิดขึ้นในระบบ สมการอิสระคือระบบสมการเคมีใด ๆ ที่ไม่สามารถได้มาซึ่งสมการใด ๆ จากการรวมสมการอื่น ๆ ในขณะที่จำนวนของส่วนประกอบสำหรับระบบดังกล่าวคือ 3: พวกมันคือ CaCO 3 , CaO และ CO 2 ข้อมูลนี้ยังช่วยให้เราสามารถคำนวณจำนวนองค์ประกอบอิสระ: n = จำนวนองค์ประกอบ – จำนวนสมการอิสระ ดังนั้น: n = 3 – 1 = 2 เราสามารถใช้ตัวอย่างเดียวกันนี้ในการคำนวณจำนวนองศาอิสระ โดยใช้สมการของกฎเฟสกิ๊บส์: s = n – f + 2 = 2 – 3 + 2 = 1 ค่านี้บ่งชี้ว่าเพื่อรักษาปริมาณเฟสให้คงที่ในสภาวะสมดุลของระบบ เราสามารถใช้ตัวแปรเข้มข้นได้เพียงตัวเดียว 
ระบบต่างกัน
ระบบใด ๆ ที่มีมากกว่าหนึ่งเฟส (ดังนั้นระบบที่ไม่ใช่เนื้อเดียวกัน) ก็จะต่างกันเช่นกัน ประเภทของเฟสไม่เกี่ยวข้อง ระบบที่แตกต่างกันอาจมีสถานะของแข็งและของเหลวหลายสถานะในเวลาเดียวกัน แต่มีเพียงสถานะก๊าซเดียวเท่านั้น นี่เป็นเพราะความจริงที่ว่าก๊าซผสมกันอย่างลงตัว ตัวอย่างที่น่าสนใจของระบบต่างชนิดกันคือหินแกรนิต ซึ่งมีเฟสของแข็งมากมาย รวมถึงควอตซ์ โพแทสเซียมเฟลด์สปาร์ พลาจิโอคลาส และไบโอไทต์ ผลิตภัณฑ์อาหารหลายชนิดสามารถเรียกได้ว่าเป็นผลิตภัณฑ์ที่ต่างกัน เช่น มูสลี่หรือซอสสลัดที่มีส่วนผสมหลายอย่างซึ่งประกอบด้วยไขมัน เครื่องเทศ และสารปรุงแต่งอื่นๆ ประเภทของสารผสมที่ไม่เป็นเนื้อเดียวกันที่น่าสนใจคือคอลลอยด์ (สารละลายที่มีส่วนประกอบสามารถแยกแยะได้ด้วยกล้องจุลทรรศน์เท่านั้น) แต่โดยมากแล้วสามารถแยกได้ด้วยวิธีการหรือเครื่องมือง่ายๆ ตัวอย่างเช่น ในการแยกส่วนผสมที่ประกอบด้วยน้ำและน้ำมัน เราสามารถใช้การริน – ส่วนผสมจะมองเห็นได้ด้วยตาเปล่า วิธีการอื่นๆ ที่เราสามารถใช้แยกของผสมที่ไม่เป็นเนื้อเดียวกันได้อย่างมีประสิทธิภาพ ได้แก่: การกรอง การแยกทางกล หรือการปั่นแยก คล้ายกับส่วนผสมของแร่ธาตุที่มีคุณสมบัติต่างกัน: ควอตซ์ ไมกา และเฟลด์สปาร์สามารถแยกออกได้แม้ใช้ค้อน
ระบบที่เป็นเนื้อเดียวกัน
ซึ่งแตกต่างจากระบบที่ต่างกัน ระบบที่เป็นเนื้อเดียวกันมีลักษณะเฉพาะด้วยการมีอยู่เพียงเฟสเดียว ในกรณีเช่นนี้ เราไม่สามารถแยกแยะองค์ประกอบด้วยตาเปล่าได้ วิธีการแยกแบบง่าย ๆ นั้นไม่ได้ผลเช่นกัน และวิธีการตามลักษณะทางกายภาพเท่านั้นที่อาจมีประโยชน์ ตัวอย่างของวิธีการดังกล่าวคือการแยกโดยการกลั่น ซึ่งขึ้นอยู่กับจุดเดือดที่หลากหลายของระบบเฉพาะ วิธีการอื่นๆ ที่มีประสิทธิภาพในการแยกของผสมที่เป็นเนื้อเดียวกัน ได้แก่ การตกผลึกและโครมาโทกราฟี ระบบเนื้อเดียวกันชนิดพิเศษคือสารบริสุทธิ์ที่มีเฟสเดียวเท่านั้นที่มีองค์ประกอบเดียวเท่านั้น อีกตัวอย่างหนึ่งคือสารละลายและสารผสมที่เป็นเนื้อเดียวกันทุกประเภท แม้ว่าจะมีเฟสเดียว แต่ระบบอาจมีส่วนประกอบหลายอย่าง เนื่องจากเฟสที่มีอยู่ในระบบสามารถเป็นของเหลว ของแข็ง หรือก๊าซได้ สารละลายจึงอาจอยู่ในรูปแบบดังกล่าวได้เช่นกัน ตัวอย่างของระบบดังกล่าว ได้แก่ ของผสมที่เป็นของเหลว (น้ำส้มสายชู น้ำ) ของผสมที่เป็นก๊าซ (อากาศในบรรยากาศ) และของผสมที่เป็นของแข็ง รวมถึงแร่แร่และโลหะผสมทุกประเภท เช่น บรอนซ์หรือทองเหลือง
การเปลี่ยนแปลงในระบบ
การเปลี่ยนผ่านสองประเภทอาจเกิดขึ้นในระบบ ซึ่งเป็นระยะ (บางครั้งเรียกว่าทางกายภาพ) และการเปลี่ยนผ่านทางเคมี อดีตรวมถึงการเปลี่ยนผ่านทั้งหมดที่ไม่ผลิตสารเคมีใหม่ พวกเขายังไม่โดดเด่นด้วยการซีดจางของส่วนประกอบที่มีอยู่แล้ว อย่างไรก็ตาม ตามชื่อที่ระบุ สิ่งเหล่านี้นำไปสู่การเปลี่ยนแปลงดังกล่าวในโครงสร้างหรือสถานะทางกายภาพ. นอกจากนี้ยังเป็นไปได้ที่เฟสใหม่จะก่อตัวขึ้นในขณะที่เฟสเดิมจะจางหายไป ตัวอย่างของการเปลี่ยนเฟส ได้แก่ การระเหิดใหม่และการเปลี่ยนสถานะหลายรูปของธาตุ การเปลี่ยนสถานะทางเคมีแสดงกลไกที่แตกต่างไปจากเดิมอย่างสิ้นเชิง นี่คือปฏิกิริยาที่ผลิตสารใหม่ที่แทนที่องค์ประกอบเดิม การเปลี่ยนผ่านดังกล่าวอาจถูกดำเนินการในสองตัวแปร ตัวอย่างเช่น ระหว่างการไฮโดรไลซิสในหนึ่งเฟสหรือมากกว่า เช่นเดียวกับระหว่างการเผาไหม้
ปฏิกริยาเคมี
- ปฏิกิริยาที่เป็นเนื้อเดียวกันเกิดขึ้นเมื่อระบบทั้งหมดรวมถึงสารตั้งต้นและผลิตภัณฑ์อยู่ในเฟสเดียว ตัวอย่างเช่น:
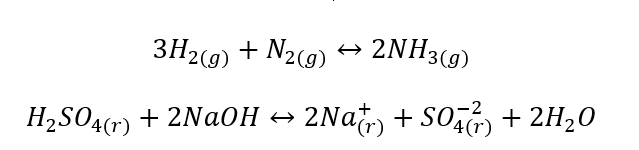
- ปฏิกิริยาต่างชนิดกันคือปฏิกิริยาที่ระบบ รวมทั้งสารตั้งต้นและผลิตภัณฑ์ อยู่ในสองขั้นตอนที่ต่างกันเป็นอย่างน้อย ปฏิกิริยาดังกล่าวมักเกิดขึ้นที่ส่วนต่อประสาน ตัวอย่างเช่น: