วิธีสเปกโทรสโกปีคือกลุ่มของวิธีการที่สัญญาณถูกสร้างขึ้นโดยอันตรกิริยาของรังสีแม่เหล็กไฟฟ้าหรือรังสีคอร์ปัสสโคปกับตัวอย่างที่ตรวจสอบ การแผ่รังสีนี้อาจเกิดขึ้นอันเป็นผลมาจากการเปลี่ยนแปลงเป็นระยะในสนามแม่เหล็กไฟฟ้าที่เกี่ยวข้องกับการถ่ายโอนพลังงาน วิธีการเหล่านี้ใช้เพื่อกำหนดความเข้มข้นหรือปริมาณของอะตอมในระบบดูดซับหรือเปล่งแสงที่กำหนด สเปกโตรโฟโตมิเตอร์มีประเภทใดบ้าง และวิธีการเหล่านี้เกี่ยวข้องกับอะไร นี่คือสิ่งที่คุณจะพบจากบทความของเรา

การเปลี่ยนผ่านของรังสีและพลังงาน
คุณสมบัติที่สำคัญที่สุดของโฟตอนหรือควอนตัมการแผ่รังสีคือพลังงาน สูตรสำหรับค่าพลังงาน (E) คือผลคูณของค่าคงที่ของพลังค์ (h) เท่ากับ 6.626·10 -34 [J ·s] และความถี่การแผ่รังสี (v) แสดงเป็นเฮิรตซ์ [Hz] 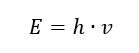 สเปกโตรโฟโตมิเตอร์ใช้การเปลี่ยนแปลงพลังงานในโมเลกุล ซึ่งเกิดจากการดูดซับหรือการปล่อยรังสีแม่เหล็กไฟฟ้าในช่วงต่างๆ:
สเปกโตรโฟโตมิเตอร์ใช้การเปลี่ยนแปลงพลังงานในโมเลกุล ซึ่งเกิดจากการดูดซับหรือการปล่อยรังสีแม่เหล็กไฟฟ้าในช่วงต่างๆ:
- อัลตราไวโอเลต (UV) 200-380 นาโนเมตร
- รังสีที่มองเห็นได้ (Vis) 380-780 นาโนเมตร
- ใกล้อินฟราเรด (IR) 0.78-30000 ไมโครเมตร
แนวคิดพื้นฐานและกฎของสเปกโตรโฟโตเมทรี
จุดไอโซเบสิก
นี่คือจุดที่สอดคล้องกับความยาวคลื่นจำเพาะซึ่งเป็นผลมาจากจุดตัดของเส้นโค้งที่ถูกพล็อตในระบบความยาวคลื่นการดูดกลืนแสง โดยที่สารประกอบทั้งสองรูปแบบในสารละลาย (แยกตัวและไม่แยกตัว) มีการดูดกลืนแสงเท่ากัน การเปลี่ยนแปลง ค่า pH จะไม่เปลี่ยนตำแหน่ง สารประกอบอาจมีจุดดังกล่าวหลายจุด
สเปกตรัมการดูดซึมของสารประกอบเคมี
สเปกตรัมคือการวัดปริมาณแสงที่สารประกอบดูดซับจากความยาวคลื่นแสง (แล) หากรังสีแม่เหล็กไฟฟ้า (แสง) ที่มีความเข้ม I 0 ตกกระทบตัวอย่าง รังสีบางส่วนจะถูกดูดซับและบางส่วนจะทะลุผ่านตัวอย่างไป ด้วยการบันทึกความเข้มของเหตุการณ์ (I 0 ) และรังสีที่ส่งผ่าน (I t ) เราสามารถกำหนดปริมาณของแสงที่ถูกดูดซับโดยสารละลาย (การดูดกลืนแสง, A) หรือที่ผ่านไปได้ (การส่งผ่าน, T)
การดูดซับ
ปริมาณที่อธิบายปรากฏการณ์การดูดซึมคือการดูดกลืนแสง นี่เป็นการวัดความเข้มของรังสีแม่เหล็กไฟฟ้าที่ไม่มีมิติสัมพันธ์กับจำนวนอะตอมอิสระ ตัวเลขนี้ถูกนำมาใช้เพื่ออำนวยความสะดวกในการคำนวณที่เกี่ยวข้องกับปริมาตรการดูดซึม การดูดซับคืออันตรกิริยาระหว่างรังสีแม่เหล็กไฟฟ้ากับสสาร ซึ่งเป็นการดูดซับพลังงานบางส่วนตามสสาร การดูดกลืนแสงเป็นสารเติมแต่งและบางครั้งเรียกว่าความหนาแน่นของแสง ในเชิงสัญลักษณ์ จะมีการบันทึกเป็น Abs หรือ A ในทางคณิตศาสตร์ มันคือลอการิทึมทศนิยมของอัตราส่วนของความเข้มของลำแสงรังสีที่ตกกระทบบนตัวอย่างทดสอบ (I 0 ) ต่อความเข้มของลำแสงรังสีที่ส่งผ่านตัวอย่างทดสอบ ( มัน ). สามารถรับค่าได้ตั้งแต่ 0 ถึงอนันต์ นิพจน์ทางคณิตศาสตร์ที่อธิบายความสัมพันธ์นี้เรียกว่ากฎเบียร์-แลมเบิร์ต การดูดซับที่ความยาวคลื่นที่กำหนดขึ้นอยู่กับค่าสัมประสิทธิ์การดูดกลืนแสง (ε) ความหนาของชั้นดูดซับ (ปกติ 1 ซม.) และความเข้มข้นของสารละลายทดสอบ
การส่งผ่าน
การส่งผ่านคืออัตราส่วนของการฉายรังสีที่ผ่านตัวอย่าง (I t ) ต่อเหตุการณ์การฉายรังสีบนตัวอย่าง (I 0 ) ซึ่งเท่ากับการฉายรังสีที่ผ่านจุดอ้างอิง ส่วนใหญ่มักแสดงเป็นเปอร์เซ็นต์และสามารถอยู่ในช่วงตั้งแต่ 0%ถึง 100%แสดงได้โดยสูตร: 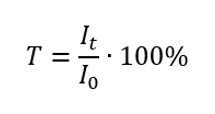 ความสัมพันธ์ระหว่างการดูดกลืนแสงและการส่งผ่านแสดงดังนี้:
ความสัมพันธ์ระหว่างการดูดกลืนแสงและการส่งผ่านแสดงดังนี้: 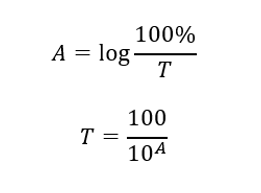
กฎหมายแลมเบิร์ต
ข้อความระบุว่าค่าการดูดกลืนแสงเป็นสัดส่วนกับความหนาของชั้นดูดซับของตัวอย่างที่เป็นเนื้อเดียวกัน สามารถบันทึกเป็นผลหารของสัมประสิทธิ์การดูดซับ (k) และความหนาของชั้นตัวอย่างที่วัดได้ (l): 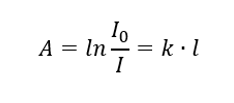

กฎหมายเบียร์-แลมเบิร์ต
เกี่ยวข้องกับการดูดซับรังสีด้วยสารละลายและสามารถกำหนดได้ดังนี้: หากค่าสัมประสิทธิ์การดูดกลืนแสงของตัวทำละลายเป็นศูนย์ การดูดกลืนแสงของลำแสงรังสีเอกรงค์เดียวที่ผ่านสารละลายที่เป็นเนื้อเดียวกันจะเป็นสัดส่วนโดยตรงกับความเข้มข้น (c) ของสารละลาย และถึงความหนาของชั้นดูดซับ (l) กฎเบียร์-แลมเบิร์ตเป็นคำจำกัดความของการดูดกลืนแสงและสามารถเขียนได้ดังนี้: 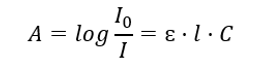 ค่าสัมประสิทธิ์การดูดกลืนแสงโดยโมล (ɛ) คือค่าคุณลักษณะของสารในตัวทำละลายตัวใดตัวหนึ่งและที่ความยาวคลื่นเฉพาะ มันเป็นสัดส่วนกับความน่าจะเป็นของการเปลี่ยนแปลงระหว่างระดับพลังงานของโมเลกุลและขึ้นอยู่กับพลังงานของโฟตอนรังสีโดยตรง ในแง่ตัวเลข มันแสดงถึงค่าการดูดกลืนแสงที่แสดงโดยสารละลายที่มีความเข้มข้น 1 โมล/dm 3 โดยมีความหนาของชั้นดูดซับ 1 ซม. การรู้ค่าสัมประสิทธิ์ทำให้สามารถกำหนดความเข้มข้นของสารละลายทดสอบได้หลังจากการวัดขนาดของการดูดกลืนแสง นอกจากนี้ ยังสามารถคำนวณค่าการดูดกลืนแสงที่คาดหวังของสารละลายได้จากค่าสัมประสิทธิ์และความเข้มข้นอีกด้วย สูตรนี้ใช้เพื่อหาความเข้มข้นของสารโดยมีค่าสัมประสิทธิ์การดูดกลืนแสงโดยโมลและการดูดกลืนแสงที่วัดได้จากเชิงประจักษ์ ซึ่งสามารถทำได้โดยใช้สูตรหรือโดยการวาดเส้นโค้งการสอบเทียบสำหรับสารหลายๆ จุดในช่วงความเข้มข้นที่คาดหวัง กฎเบียร์-แลมเบิร์ตสามารถแสดงเป็นการขึ้นอยู่กับความเข้มข้นของการดูดซึม: A = f(C)
ค่าสัมประสิทธิ์การดูดกลืนแสงโดยโมล (ɛ) คือค่าคุณลักษณะของสารในตัวทำละลายตัวใดตัวหนึ่งและที่ความยาวคลื่นเฉพาะ มันเป็นสัดส่วนกับความน่าจะเป็นของการเปลี่ยนแปลงระหว่างระดับพลังงานของโมเลกุลและขึ้นอยู่กับพลังงานของโฟตอนรังสีโดยตรง ในแง่ตัวเลข มันแสดงถึงค่าการดูดกลืนแสงที่แสดงโดยสารละลายที่มีความเข้มข้น 1 โมล/dm 3 โดยมีความหนาของชั้นดูดซับ 1 ซม. การรู้ค่าสัมประสิทธิ์ทำให้สามารถกำหนดความเข้มข้นของสารละลายทดสอบได้หลังจากการวัดขนาดของการดูดกลืนแสง นอกจากนี้ ยังสามารถคำนวณค่าการดูดกลืนแสงที่คาดหวังของสารละลายได้จากค่าสัมประสิทธิ์และความเข้มข้นอีกด้วย สูตรนี้ใช้เพื่อหาความเข้มข้นของสารโดยมีค่าสัมประสิทธิ์การดูดกลืนแสงโดยโมลและการดูดกลืนแสงที่วัดได้จากเชิงประจักษ์ ซึ่งสามารถทำได้โดยใช้สูตรหรือโดยการวาดเส้นโค้งการสอบเทียบสำหรับสารหลายๆ จุดในช่วงความเข้มข้นที่คาดหวัง กฎเบียร์-แลมเบิร์ตสามารถแสดงเป็นการขึ้นอยู่กับความเข้มข้นของการดูดซึม: A = f(C)
กฎแห่งการบวก
กฎเบียร์-แลมเบิร์ต หมายถึง กรณีที่มีสารดูดซับอยู่ในสารละลาย อย่างไรก็ตาม หากมีสารจำนวนมากในสารละลายหลายองค์ประกอบที่ดูดซับรังสีที่ความยาวคลื่นที่เลือก ค่าการดูดกลืนแสงของสารละลายนี้ (A) จะเท่ากับผลรวมของการดูดกลืนแสงของส่วนประกอบแต่ละส่วน (A 1 , A 2 ,…) กล่าวคือ A=A 1 +A 2 +⋯+A น . เป็นที่น่าสังเกตและจดจำว่าค่าการดูดกลืนแสงของแต่ละองค์ประกอบเป็นผลคูณของความเข้มข้นและค่าสัมประสิทธิ์การดูดกลืนแสงของฟันกรามที่สอดคล้องกัน นี่คือกฎการดูดกลืนแสงข้อที่ 3 ซึ่งใช้ในการวิเคราะห์สเปกโตรโฟโตเมตริกของระบบหลายองค์ประกอบ
การเบี่ยงเบนจากกฎการดูดซึม
ข้อกำหนดเบื้องต้นเพื่อให้เป็นไปตามกฎการดูดกลืนแสงคือรังสีที่กระทำต่อระบบนั้นมีสีเดียวและมีความเข้มไม่สูงเกินไป สาเหตุของการเบี่ยงเบนจากกฎหมายเบียร์ – แลมเบิร์ตอาจเป็น:
- ความไม่สมบูรณ์ของเครื่องมือวัดส่งผลให้ไม่เป็นไปตามเงื่อนไข
- ปฏิกิริยาเคมีที่เกิดขึ้นระหว่างการตรวจวัด เช่น ปฏิกิริยาโพลีเมอ ไรเซชัน ไฮโดรไลซิส การควบแน่น
- ความขุ่นของสารละลาย
การประยุกต์ใช้สเปกตรัมการดูดกลืนอิเล็กตรอน
- ช่วยให้กำหนดประเภทของการเปลี่ยนผ่านของอิเล็กตรอนได้โดยการตรวจสอบสเปกตรัมในตัวทำละลายที่มีขั้วต่างกัน
- ความแตกต่างในตำแหน่งและความเข้มของแถบการดูดซับของรูปแบบโมเลกุลที่แตกต่างกันนั้นใช้เพื่อศึกษาสมดุลที่สร้างขึ้นระหว่างพวกมันในสารละลาย ( การศึกษาเชิงโครงสร้าง , สมดุลของเทาโทเมอร์).
- ใช้สำหรับการกำหนดสารประกอบตามกฎหมายเบียร์-แลมเบอร์
- ใช้เป็นวิธีการระบุเพิ่มเติมโดยอิงตามตำแหน่ง สูงสุด ของสารทดสอบ
- ใช้ในการกำหนดความบริสุทธิ์ของสารประกอบทดสอบ โดยเปลี่ยนตำแหน่งสูงสุดของการดูดกลืนแสง โดยเปรียบเทียบอัตราส่วนของค่าการดูดกลืนแสงที่จุดสองจุดที่แตกต่างกันในสเปกตรัม

สเปกโทรสโกปีอิเล็กตรอน UV-Vis
ในแง่ของปรากฏการณ์การดูดกลืนแสง UV-Vis spectrophotometry เป็นเทคนิคที่น่าสนใจเป็นพิเศษ ซึ่งช่วยให้สามารถวิเคราะห์สารหลายชนิดได้ ในเชิงคุณภาพ และ เชิงปริมาณ ปรากฏการณ์การดูดกลืนรังสีจะใช้เมื่อ: การดูดกลืนแสงขึ้นอยู่กับความเข้มข้นเป็นเส้นตรง หรือเมื่อการดูดกลืนแสงเป็นแบบเติมแต่ง กล่าวคือ สำหรับสารละลายที่มีหลายองค์ประกอบ ผลรวมของการดูดกลืนแสงของส่วนประกอบต่างๆ เป็นไปตามเงื่อนไขเมื่อไม่มีปฏิสัมพันธ์ระหว่างโมเลกุลในระบบ ด้วยการวิเคราะห์สเปกตรัมการดูดกลืนแสง UV-Vis ที่เกิดจากการแผ่รังสีแม่เหล็กไฟฟ้าผ่านสารละลาย จะสังเกตการเปลี่ยนเวเลนซ์อิเล็กตรอนจากพื้นดินไปสู่สถานะตื่นเต้นได้ ปรากฏการณ์นี้ส่งผลให้เกิดการดูดกลืนรังสีบางส่วนที่ความยาวคลื่นบางช่วง การดูดซึมเป็นผลมาจากการเปลี่ยนอิเล็กตรอนไปสู่ระดับพลังงานที่สูงขึ้น แต่เพื่อให้สิ่งนี้เกิดขึ้น ควอนตัมของรังสีแม่เหล็กไฟฟ้าจะต้องมีพลังงานเพียงพอที่จะสร้างความสมดุลของความแตกต่างพลังงานระหว่างระดับพลังงาน ในโมเลกุล พลังงานดังกล่าวจะมีอิเล็กตรอนโวลต์จำนวนหนึ่ง ซึ่งสอดคล้องกับความถี่ UV-Vis อย่างแม่นยำ
โครโมฟอร์
สารประกอบที่แสดงการดูดซึมในช่วง UV-Vis จะมีโครโมฟอร์อยู่ในโครงสร้าง กล่าวคือ กลุ่มของอะตอมที่อิเล็กตรอนมีลักษณะเฉพาะด้วยพลังงานกระตุ้นต่ำ กล่าวอีกนัยหนึ่ง โครโมฟอร์เป็นส่วนหนึ่งของโมเลกุล (กลุ่มอะตอม) ที่รับผิดชอบในการดูดกลืนรังสีแบบเลือกสรรในช่วงที่มองเห็นได้ (180-800 นาโนเมตร) และทำให้เกิดสีขึ้น ซึ่งรวมถึง: วงแหวนอะโรมาติก (เซ็กเทตอิเล็กตรอนแบบอะโรมาติก) พันธะหลายพันธะ (ส่วนหนึ่งคือพันธะชนิด π) ทั้งระหว่างอะตอมของคาร์บอนกับอะตอมอื่นๆ เช่น หมู่คาร์บอนิล C=O
ออโซโครเมส
อะตอมอีกกลุ่มหนึ่งคือออกโซโครม กล่าวคือองค์ประกอบทดแทนที่ไม่แสดงการดูดซึมในช่วง UV-Vis แต่การมีอยู่ของพวกมันทำให้เกิดการเปลี่ยนแปลงในสเปกตรัมขององค์ประกอบที่ดูดซับ พวกมันเสริมการทำงานของโครโมฟอร์ ซึ่งเรามักจะสังเกตได้ในรูปแบบของการให้สีที่เข้มข้นกว่าของสารทดสอบมากกว่าในกรณีที่ไม่มีอยู่ในระบบ นอกจากนี้ เรายังแบ่งออกโซโครมออกเป็น บาโทโครม เช่น –NH 2 , -OH ซึ่งจะเปลี่ยนค่าการดูดกลืนแสงสูงสุดไปยังความยาวคลื่นที่ยาวขึ้น และ ไฮโซโครม เช่น –CH 3 , -CO ซึ่งจะเปลี่ยนค่าสูงสุดไปทางความยาวคลื่นที่สั้นลง
สเปกโทรสโกปีการดูดซึมอะตอม (AAS)
นี่เป็นอีกเทคนิคหนึ่งที่ใช้ปรากฏการณ์การดูดซึม ใช้ในการระบุ องค์ประกอบทางเคมี ในรูปแบบของตัวอย่างในสถานะใดๆ (ของเหลว ของแข็ง ก๊าซ) และการวัดนั้นขึ้นอยู่กับการสังเกตการดูดกลืนรังสีของความยาวคลื่นเฉพาะโดยอะตอมของโลหะอิสระ พื้นฐานของเทคนิคคืออะตอมสามารถดูดซับรังสีแม่เหล็กไฟฟ้าที่ความยาวคลื่นที่สามารถเปล่งออกมาได้เช่นกัน และนี่เป็นลักษณะเฉพาะขององค์ประกอบที่กำหนดเท่านั้น เมื่อพลังงานที่จ่ายให้กับอะตอมสูงขึ้น อิเล็กตรอนจะตื่นเต้นไปยังระดับที่สูงขึ้นและมีเส้นสเปกตรัมจำนวนมากขึ้น หากพลังงานที่ให้มาสอดคล้องกับศักย์ไอออไนเซชันของอะตอม จะเกิดไอออน เช่น Na + ขึ้นมา พื้นฐานสำหรับการวิเคราะห์เชิงปริมาณโดยใช้สเปกโตรมิเตอร์การดูดกลืนแสงของอะตอมคือสัดส่วนของการดูดกลืนแสงกับจำนวนอะตอมที่ดูดซับและกฎของเบียร์-แลมเบิร์ต






















































































































