อิเล็กโทรเนกาติวีตี้คือปริมาณที่สะท้อนถึงแนวโน้มของอะตอมที่กำหนดภายในโมเลกุลเพื่อดึงดูดอิเล็กตรอนเข้าหาตัวมันเอง ในทางปฏิบัติ มันคือความสามารถของอะตอมหรือหมู่ฟังก์ชันในการดึงดูดความหนาแน่นของอิเล็กตรอน มาตราส่วนที่ใช้กันมากที่สุดที่เกี่ยวข้องกับปริมาณนี้คือมาตราส่วนที่แนะนำโดย Linus Pauling ซึ่งทำให้สามารถคำนวณลักษณะโดยประมาณของพันธะได้อย่างง่ายดาย

ลักษณะอิเล็กโทรเนกาติวีตี้
โมเลกุลโฮมอนนิวเคลียร์ เช่น H 2 และ O 2 มีค่าสัมประสิทธิ์ c A และ c B เท่ากันในออร์บิทัลโมเลกุล ซึ่งสามารถบันทึกเป็นฟังก์ชันคลื่นได้: Ψ +AB = c A Ψ A + c B Ψ B Ψ −AB = c A Ψ A − c B Ψ B ในกรณีนี้ วงโคจรมีลักษณะเฉพาะคือรูปร่างสมมาตรเมื่อเทียบกับจุดศูนย์กลางของโมเลกุล และประจุไฟฟ้ามีการกระจายภายในสมมาตรเท่ากัน อย่างไรก็ตาม อีกตัวอย่างหนึ่งคือโมเลกุลเฮเทอโรนิวเคลียร์ ซึ่งแทบเป็นไปไม่ได้เลยที่จะรักษาค่าสัมประสิทธิ์ที่เท่ากัน รวมถึงความสมมาตรโดยสมบูรณ์เมื่อเทียบกับศูนย์กลางของโมเลกุล เมื่อระดับพลังงานของออร์บิทัลอะตอม Ψ B ต่ำกว่าระดับพลังงานของออร์บิทัลอะตอม Ψ A ความสัมพันธ์จะเกิดขึ้น และความหนาแน่นของความน่าจะเป็นของอิเล็กตรอนสูงสุดจะเลื่อนไปทางอะตอม B ในทางปฏิบัติ สิ่งนี้ส่งผลให้เกิดการเปลี่ยนแปลงของอิเล็กตรอน จับคู่กันในพันธะเคมี กล่าวคือ โพลาไรเซชันต่ออะตอม B ตัวอย่างเช่น ในโมเลกุลลิเธียมไฮไดรด์ LiH การเปลี่ยนแปลงนี้จะไปทางอะตอมไฮโดรเจน ในขณะที่โมเลกุลไฮโดรเจนฟลูออไรด์ HF จะหันไปทางอะตอมของฟลูออรีน ซึ่งหมายความว่าอะตอมไฮโดรเจนมีระดับพลังงานต่ำกว่าลิเธียม แต่มีระดับพลังงานสูงกว่าฟลูออรีน (อ่านเกี่ยวกับ ฮาโลเจน ) ภายใต้เงื่อนไขเหล่านี้ อะตอมหนึ่งของโมเลกุลทั้งสองจะมีประจุลบซึ่งแสดงเป็น -δ และอีกอะตอมหนึ่งคือบวก +δ สูตรทั่วไปของโมเลกุลดังกล่าวคือ A +δ B -δ .
ประจุของอะตอม
ประจุ δ ที่กล่าวมาข้างต้นสามารถรับค่าที่แตกต่างกันได้ ขึ้นอยู่กับองค์ประกอบที่ถูกผูกไว้ด้วย พันธะเคมี ค่าของมันที่เป็น 0 หมายความว่าประจุของคู่อิเล็กตรอนมีการกระจายอย่างสมมาตร และทั้งคู่นั้นตั้งอยู่ใกล้อะตอมโดยสมบูรณ์โดยมีระดับพลังงานต่ำกว่า ส่งผลให้มีการถ่ายโอนอิเล็กตรอนทั้งสองตัวไปยังอะตอมนั้น สิ่งนี้จะสร้างพันธะไอออนิกระหว่างองค์ประกอบต่างๆ อย่างไรก็ตาม ในพันธะเคมีส่วนใหญ่จะมีประจุเป็นเศษส่วน ทำให้เกิดสถานะระหว่างพันธะโควาเลนต์และไอออนิก
โมเมนต์ไดโพล
ไดโพลเป็นโมเลกุลที่สามารถแยกแยะขั้วสองขั้ว – บวกและลบได้ โมเมนต์ไดโพลซึ่งแสดงด้วย μ เป็นการวัดขนาดของการเปลี่ยนแปลงประจุไฟฟ้าในนั้น มันถูกกำหนดให้เป็นผลคูณของค่าสัมบูรณ์ของประจุไฟฟ้า (δ) ที่มีอยู่ในขั้วใดขั้วหนึ่งและระยะห่างจากขั้วเหล่านี้ (l): μ = δ · l ประจุบวก (δ+) และประจุลบ ( δ-) เรียกว่าประจุบางส่วนและตำแหน่งของประจุนั้นเกิดจากอะตอมใดอะตอมหนึ่ง แต่ในความเป็นจริงแล้ว ความน่าจะเป็นที่อิเล็กตรอนจะอยู่รอบๆ นิวเคลียสของพวกมันจะมากหรือน้อยเท่านั้น ปรากฏการณ์ดังกล่าวบางครั้งสับสนกับกระบวนการ ออกซิเดชันและการรีดักชัน แต่ไม่เหมือนกับการเปลี่ยนแปลงที่เกิดขึ้นในนั้น ประจุดังกล่าวที่อะตอมได้รับนั้นไม่ได้ทำให้พวกเขาเคลื่อนที่ไปยังสถานะออกซิเดชันอื่น ดังนั้นจึงไม่มีการแลกเปลี่ยนอิเล็กตรอนระหว่าง พวกเขา. หน่วย SI สำหรับแสดงโมเมนต์ไดโพลคือคูลอมบ์เมตร (C·m) อย่างไรก็ตาม ในการคำนวณหน่วยที่เขียนในระบบ CGS มักใช้ debye (D) เดบายหนึ่งครั้งมีค่าเท่ากับ 3.33564·10 -30 C·m โมเมนต์ไดโพลที่ใหญ่ที่สุดที่เป็นไปได้ในทางทฤษฎีจะแสดงลักษณะของโมเลกุลที่มีพันธะไอออนิกล้วนๆ ในขณะที่สิ่งที่เล็กที่สุดเกิดขึ้นในโมเลกุลที่มีพันธะเป็นโควาเลนต์ล้วนๆ – โมเมนต์ไดโพลในกรณีนี้คือศูนย์ อย่างไรก็ตาม ส่วนใหญ่เป็นกรณีกลางที่มีอักขระของอนุภาคต่างกัน
โมเมนต์ไดโพลฮาโลเจน
ความสัมพันธ์หลายประการระหว่างอิเล็กโตรเนกาติวีตี้และโมเมนต์ไดโพลสามารถสังเกตได้ง่ายในสารประกอบเคมีจำเพาะ ตารางที่ 1 โมเมนต์ไดโพลของไฮโดรเจนเฮไลด์
| สารประกอบ | โมเมนต์ไดโพลที่กำหนดโดยการทดลอง [ μ, D] | ความยาวพันธบัตร [pm] | ผลคูณของประจุธาตุและความยาวไดโพล [e ·l, D] | ส่วนแบ่งของอักขระไอออนิก [ %] | ความแตกต่างในอิเลคโตรเนกาติวีตี้ของฮาโลเจนและไฮโดรเจน |
| เอชเอฟ | 1.98 | 92 | 4.42 | 45 | 1.9 |
| เอชซีแอล | 1.08 | 128 | 6.15 | 18 | 0.9 |
| ฮบ | 0.79 | 143 | 6.87 | 12 | 0.7 |
| สวัสดี | 0.38 | 162 | 7.78 | 5 | 0.4 |
อัตราส่วน μ/(e·l’) กล่าวคือ โมเมนต์ไดโพลจริงต่อโมเมนต์ไดโพลที่สอดคล้องกับพันธะไอออนิก สามารถให้การวัดความเบี่ยงเบนจากพันธะโควาเลนต์ทั้งหมดได้ ผลคูณของความสัมพันธ์นี้ในรูปของ (μ/(e·l’))·100%แสดงถึงเปอร์เซ็นต์ของอักขระไอออนิกในพันธะ นี่เป็นเพียงค่าโดยประมาณ เนื่องจากโมเมนต์ไดโพลไม่เพียงขึ้นอยู่กับขั้วของพันธะเท่านั้น แต่ยังขึ้นอยู่กับพฤติกรรมของคู่อิเล็กตรอนอิสระด้วย มันเกิดขึ้นที่เมฆอิเล็กตรอนสามารถเลื่อนออกไปด้านนอกของโมเลกุลได้ ผลที่ตามมาคือสมการในการกำหนดโมเมนต์ไดโพลนั้นมีองค์ประกอบเพิ่มเติม ในกรณีของโมเลกุลแอมโมเนีย เมฆจะพุ่งไปในแนวเดียวกันกับโมเมนต์ไดโพลของพันธะ ส่งผลให้โมเมนต์ไดโพลที่ได้เพิ่มขึ้น ในทางตรงกันข้าม สิ่งที่ตรงกันข้ามจะเกิดขึ้นกับโมเลกุลของคาร์บอนมอนอกไซด์ โดยที่เมฆมุ่งไปในทิศทางตรงกันข้าม และส่งผลให้โมเมนต์ไดโพลที่เป็นผลลัพธ์ลดลง 
อิเล็กโทรเนกาติวีตี้
เป็นปริมาณเชิงประจักษ์ไร้มิติที่สะท้อนถึงแนวโน้มของอะตอมที่กำหนดภายในโมเลกุลเพื่อดึงดูดอิเล็กตรอนเข้าหาตัวมันเอง ในทางปฏิบัติ มันคือความสามารถของอะตอมหรือหมู่ฟังก์ชันในการดึงดูดความหนาแน่นของอิเล็กตรอน มาตราส่วนที่ใช้กันมากที่สุดที่เกี่ยวข้องกับปริมาณนี้คือมาตราส่วนที่แนะนำโดย Linus Pauling ซึ่งทำให้สามารถคำนวณลักษณะโดยประมาณของพันธะได้อย่างง่ายดาย นักวิทยาศาสตร์ใช้วิธีการต่อไปนี้ในการคำนวณอิเลคโตรเนกาติวีตี้ของแต่ละองค์ประกอบ: เราถือว่า D AA และ D BB เป็นพลังงานพันธะของโมเลกุลสองอะตอม (A 2 , B 2 ) เรากำหนดพลังงานยึดเหนี่ยวที่เกิดขึ้นในโมเลกุลเป็น D AB จากการทดลองพบว่า หากพันธะดังกล่าวมีอักขระไอออนิกเพียงเล็กน้อยหรือไม่มีเลย ความแตกต่างระหว่างค่า D AB และค่าเฉลี่ยเรขาคณิตของค่าพลังงาน D AA และ D BB จะเท่ากับหรือใกล้กับศูนย์ เมื่อพันธะ AB มีการเบี่ยงเบนจากลักษณะโควาเลนต์อย่างชัดเจน ความแตกต่างนี้จะเกิดขึ้นกับค่าบวก ซึ่งจะเพิ่มขึ้นเมื่อสัดส่วนของลักษณะไอออนิกเพิ่มขึ้น ความแตกต่างระหว่างอิเล็กโตรเนกาติวีตี้ (x) ของอะตอมทั้งสองที่เกี่ยวข้องกับพันธะแสดงโดยสูตร: ![]() ดังนั้น หาก Pauling ถือว่าค่าอิเล็กโตรเนกาติวีตี้ของฟลูออรีนเท่ากับ 4.0 ในการคำนวณ ก็เป็นไปได้ที่จะคำนวณค่าอิเลคโตรเนกาติวิตี้ขององค์ประกอบต่างๆ ในภายหลัง หากเราทราบค่า x A ของอะตอมขององค์ประกอบ A และค่าของสัมประสิทธิ์ Δ’ เราก็จะสามารถคำนวณค่า x B ได้โดยใช้สมการข้างต้น มาตราส่วนพอลลิ่งถูกสร้างขึ้นในลักษณะที่ค่าของมันสอดคล้องกับค่าของโมเมนต์ไดโพลของพันธะที่เกิดขึ้นโดยอะตอมที่กำลังพิจารณาโดยประมาณ ดังที่เราเห็นได้จากตัวอย่างในตารางที่ 1 ซึ่งประกอบด้วยค่าที่กำหนดสำหรับไฮโดรเจนเฮไลด์ . นอกจากมาตราส่วนที่อธิบายไว้ข้างต้นแล้ว ยังมีการอธิบายอีกหลายประการในวรรณกรรมทางวิทยาศาสตร์ ซึ่งรวมถึงอิเลคโตรเนกาติวีตี้ที่อธิบายโดย:
ดังนั้น หาก Pauling ถือว่าค่าอิเล็กโตรเนกาติวีตี้ของฟลูออรีนเท่ากับ 4.0 ในการคำนวณ ก็เป็นไปได้ที่จะคำนวณค่าอิเลคโตรเนกาติวิตี้ขององค์ประกอบต่างๆ ในภายหลัง หากเราทราบค่า x A ของอะตอมขององค์ประกอบ A และค่าของสัมประสิทธิ์ Δ’ เราก็จะสามารถคำนวณค่า x B ได้โดยใช้สมการข้างต้น มาตราส่วนพอลลิ่งถูกสร้างขึ้นในลักษณะที่ค่าของมันสอดคล้องกับค่าของโมเมนต์ไดโพลของพันธะที่เกิดขึ้นโดยอะตอมที่กำลังพิจารณาโดยประมาณ ดังที่เราเห็นได้จากตัวอย่างในตารางที่ 1 ซึ่งประกอบด้วยค่าที่กำหนดสำหรับไฮโดรเจนเฮไลด์ . นอกจากมาตราส่วนที่อธิบายไว้ข้างต้นแล้ว ยังมีการอธิบายอีกหลายประการในวรรณกรรมทางวิทยาศาสตร์ ซึ่งรวมถึงอิเลคโตรเนกาติวีตี้ที่อธิบายโดย:
- Mulliken ซึ่งผลงานของเขาสันนิษฐานว่าอิเลคโตรเนกาติวีตี้ของธาตุเป็นสัดส่วนโดยตรงกับผลรวมของสัมพรรคภาพอิเล็กตรอนและพลังงานไอออไนเซชัน ความสัมพันธ์ของอิเล็กตรอน ซึ่งเป็นปริมาณพลังงานที่ปล่อยออกมาเนื่องจากการเกาะติดของอิเล็กตรอนกับอะตอมที่เป็นกลาง และพลังงานไอออไนเซชันเท่ากับปริมาณพลังงานที่ต้องใช้เพื่อแยกอิเล็กตรอนออกจากอะตอมที่เป็นกลาง ดังนั้นค่าอิเล็กโตรเนกาติวิตีที่สูงที่สุดจึงเป็นลักษณะเฉพาะของอะตอมที่มีสัมพรรคภาพอิเล็กตรอนสูงและมีพลังงานไอออไนเซชันสูง
- ออลเรดและโรโชว ซึ่งถือว่าสัดส่วนของอิเล็กโตรเนกาติวีตี้เป็นการวัดแรงที่นิวเคลียสของอะตอม (Z) กระทำต่อเวเลนซ์อิเล็กตรอน บันทึกเป็น
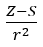 (r – รัศมีอะตอม, S – ค่าคงที่การคัดกรอง) ตามทฤษฎีของพวกเขา อิเลคโตรเนกาติวีตี้ (x) ขององค์ประกอบสามารถคำนวณได้โดยใช้สูตร:
(r – รัศมีอะตอม, S – ค่าคงที่การคัดกรอง) ตามทฤษฎีของพวกเขา อิเลคโตรเนกาติวีตี้ (x) ขององค์ประกอบสามารถคำนวณได้โดยใช้สูตร:
![]() ในแต่ละสเกล อิเล็กโตรเนกาติวีตี้ของไฮโดรเจนมีค่าใกล้เคียง 2.2 โดยค่าอื่นๆ จะแตกต่างไปเล็กน้อย ตัวอย่างของอิเลคโตรเนกาติวิตีของอะตอมของธาตุที่คำนวณตามมาตราส่วน Pauling, Mulliken และ Allred และ Rochow แสดงอยู่ในตารางที่ 2 ด้านล่าง ตารางที่ 2 ค่าอิเล็กโทรเนกาติวิตี้ขององค์ประกอบตัวอย่างบนเครื่องชั่ง Pauling (P), Mulliken (M) และ Allred และ Rochow (AR)
ในแต่ละสเกล อิเล็กโตรเนกาติวีตี้ของไฮโดรเจนมีค่าใกล้เคียง 2.2 โดยค่าอื่นๆ จะแตกต่างไปเล็กน้อย ตัวอย่างของอิเลคโตรเนกาติวิตีของอะตอมของธาตุที่คำนวณตามมาตราส่วน Pauling, Mulliken และ Allred และ Rochow แสดงอยู่ในตารางที่ 2 ด้านล่าง ตารางที่ 2 ค่าอิเล็กโทรเนกาติวิตี้ขององค์ประกอบตัวอย่างบนเครื่องชั่ง Pauling (P), Mulliken (M) และ Allred และ Rochow (AR)
| อะตอม | ป | ม | เออาร์ |
| เอฟ | 3.98 | 3.90 | 4.10 |
| โอ | 3.44 | 3.04 | 3.50 |
| เอ็น | 3.04 | 2.28 | 3.07 |
| Cl | 3.16 | 2.95 | 2.83 |
| ค | 2.55 | 1.75 | 2.50 |
| ชม | 2.20 | 2.21 | 2.20 |
| ศรี | 1.90 | 2.25 | 1.74 |
| เอฟ | 0.82 | 0.77 | 0.91 |
| รบี | 0.82 | 0.50 | 0.89 |
| คส | 0.79 | – | 0.86 |
| คุณพ่อ | 0.70 | – | 0.86 |
แม้ว่าการคำนวณของทั้งสามวิธีจะมีความคลาดเคลื่อน แต่ฟลูออรีนก็มีอิเล็กโตรเนกาติวีตี้สูงที่สุดในแต่ละสเกล ตามมาด้วยออกซิเจน ไนโตรเจน และ คลอรีน ค่าต่ำสุดถูกกำหนดไว้สำหรับแฟรนเซียม ซีเซียม รูบิเดียม และโพแทสเซียม องค์ประกอบที่โดยปกติแล้วไม่ใช่โลหะจะมีอิเล็กโทรเนกาติวีตี้สูงกว่าค่า 2 โลหะทั่วไปจะมีอิเล็กโตรเนกาติวีตี้ต่ำกว่า 2 ค่ามาตรฐานคืออิเล็กโตรเนกาติวีตี้ของไฮโดรเจนที่กล่าวมาข้างต้นประมาณ 2.2 
อิเล็กโทรเนกาติวีตี้ในตารางธาตุ
เช่นเดียวกับคุณสมบัติอื่นๆ อิเลคโตรเนกาติวีตี้ยังสะท้อนให้เห็นในการจัดเรียง องค์ประกอบทางเคมีบนตารางธาตุ ด้วย ในกลุ่ม อิเลคโตรเนกาติวีตี้จะลดลงตามจำนวนเปลือกและลักษณะโลหะที่เพิ่มขึ้น ดังนั้นจึงเพิ่มทิศทางจากแฟรนเซียมไปเป็นไฮโดรเจน เมื่อเวลาผ่านไป อิเล็กโตรเนกาติวีตี้จะเพิ่มขึ้นตามการเพิ่มขึ้นของเวเลนซ์อิเล็กตรอนที่มีอยู่ และคุณสมบัติที่ไม่ใช่โลหะลดลง ดังนั้นตั้งแต่โลหะไปจนถึง ก๊าซมีตระกูล
อิเล็กโทรเนกาติวีตี้และประเภทของพันธะ – สรุป
เมื่อรู้ค่าอิเลคโตรเนกาติวีตี้ของแต่ละองค์ประกอบที่ก่อให้เกิดพันธะเคมีแล้ว เราก็สามารถอนุมานธรรมชาติของมันได้ หากความแตกต่างอยู่ระหว่าง 0.0 ถึง 0.4 แสดงว่าพันธะนั้นเป็นโคเวเลนต์ เมื่อความแตกต่างอยู่ระหว่าง 0.4 ถึง 1.7 พันธะจะเป็นโควาเลนต์แบบโพลาไรซ์ ความแตกต่างที่สูงกว่า 1.7 ในอิเลคโตรเนกาติวีตี้ขององค์ประกอบบ่งบอกถึงพันธะไอออนิก
