ในแง่ของโครงสร้างทางเคมี แอลเคนอยู่ในกลุ่มของไฮโดรคาร์บอน สารประกอบเหล่านี้ประกอบด้วยอะตอมเพียง 2 ชนิด ได้แก่ คาร์บอนและไฮโดรเจน ประกอบด้วยโครงร่างคาร์บอนพื้นฐานที่เชื่อมโยงกับอะตอมของไฮโดรเจน แอลเคนมีพันธะเดี่ยวเท่านั้น จึงเรียกว่าไฮโดรคาร์บอนอิ่มตัว

ซีรีส์ที่คล้ายคลึงกัน
จัดเรียงตามจำนวนอะตอมไฮโดรเจนที่เพิ่มขึ้นในโครงสร้าง ตัวแทนของอัลเคนก่อตัวเป็นอนุกรมที่คล้ายคลึงกัน มันเริ่มต้นด้วยก๊าซมีเทนที่มีคาร์บอน 1 อะตอม และจบลงด้วยดีเคนที่มีคาร์บอน 9 อะตอม ชื่อของแอลเคนมาจากจำนวนอะตอมของคาร์บอนที่มีอยู่ในโครงสร้างและกำหนดด้วยตัวเลขกรีกหรือละตินรวมถึงลักษณะเฉพาะที่ลงท้ายด้วยแอน เช่นเดียวกับเฮปเทน โนแนน เป็นต้น สูตรทั่วไปสำหรับแอลเคนมีดังต่อไปนี้: โดยที่ ‘n’ หมายถึงจำนวนคาร์บอน (C) ที่มีอยู่ในห่วงโซ่ และ ‘H’ หมายถึงอะตอมของไฮโดรเจน
| จำนวนอะตอมของคาร์บอนที่อยู่ในห่วงโซ่ | สูตรอัลเคน | ชื่อแอลเคน |
| 1 | ช 4 | มีเทน |
| 2 | ซี 2 เอช 6 | อีเทน |
| 3 | ซี 3 เอช 8 | โพรเพน |
| 4 | ซี 4 เอช 10 | บิวเทน |
| 5 | ค 5 เอช 12 | เพนเทน |
| 6 | ค 6 ห 14 | เฮกเซน |
| 7 | ค 7 ห 16 | เฮปเทน |
| 8 | ค 8 เอช 18 | ออกเทน |
| 9 | ค 9 เอช 20 | โนเน่ |
| 10 | ค 10 เอช 22 | เดเคน |
ประเภทของไฮโดรคาร์บอนอิ่มตัว
ในแง่ของโครงสร้างโซ่ เราแยกแยะประเภทของอัลเคนดังต่อไปนี้:
-
เชิงเส้น (พาราฟิน) อัลเคน
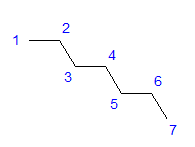 รูปที่ 1 สูตรโครงสร้างของเฮปเทน อะตอมของคาร์บอนทั้งหมดแสดง sp 3 ไฮบริไดเซชัน เนื่องจากพันธะมีมุม 6 เหลี่ยม จึงต้องมีการจัดเรียงอะตอมของคาร์บอนเป็นรูปซิกแซก โมเลกุลอาจใช้การจัดเรียงต่างๆ เนื่องจากการหมุนอย่างอิสระเป็นไปได้รอบพันธะเดี่ยวระหว่างอะตอมของคาร์บอน ยิ่งจำนวนคาร์บอนในโครงสร้างสูงเท่าใด รูปร่างของโซ่ก็จะยิ่งหลากหลายมากขึ้นเท่านั้น
รูปที่ 1 สูตรโครงสร้างของเฮปเทน อะตอมของคาร์บอนทั้งหมดแสดง sp 3 ไฮบริไดเซชัน เนื่องจากพันธะมีมุม 6 เหลี่ยม จึงต้องมีการจัดเรียงอะตอมของคาร์บอนเป็นรูปซิกแซก โมเลกุลอาจใช้การจัดเรียงต่างๆ เนื่องจากการหมุนอย่างอิสระเป็นไปได้รอบพันธะเดี่ยวระหว่างอะตอมของคาร์บอน ยิ่งจำนวนคาร์บอนในโครงสร้างสูงเท่าใด รูปร่างของโซ่ก็จะยิ่งหลากหลายมากขึ้นเท่านั้น
-
Isoalkanes: ไฮโดรคาร์บอนอิ่มตัวแตกแขนง
การก่อตัวของไฮโดรคาร์บอนที่แตกกิ่งเป็นผลของการเชื่อมโยงระหว่างอะตอมของคาร์บอนกับอะตอมของคาร์บอนอื่นๆ มากกว่าสองอะตอม สาขาถูกสร้างขึ้นที่จุดเชื่อมโยงดังกล่าว ไฮโดรคาร์บอนที่มีกิ่งเป็นไอโซเมอร์ไฮโดรคาร์บอนเชิงเส้น 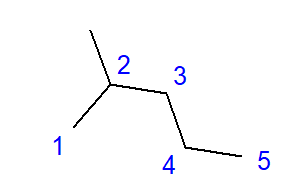 รูปที่ 2 สูตรโครงสร้างสำหรับ 2-เมทิลเพนเทน สูตรสำหรับ 2-เมทิลเพนเทนที่แสดงในรูปที่ 2 มีอะตอมของคาร์บอนทั้งหมดหกอะตอมและเป็นไอโซเมอร์เฮกเซน ชื่อ ‘2-เมทิลเพนเทน’ หมายความว่าสายโซ่เพนเทนมีหมู่เมทิลเชื่อมโยงที่ตำแหน่งของอะตอมของคาร์บอนตัวที่สอง จำนวนไอโซเมอร์โครงสร้างที่เป็นไปได้จะเพิ่มขึ้นตามจำนวนคาร์บอนที่เพิ่มขึ้น ตัวอย่างเช่น เฮกเซนสามารถมีโครงสร้างของไอโซเมอร์ที่แตกต่างกันได้ 5 ไอโซเมอร์ ออกเทนมีความเป็นไปได้ดังกล่าว 18 ชนิด และเฮกเซนมากถึง 75
รูปที่ 2 สูตรโครงสร้างสำหรับ 2-เมทิลเพนเทน สูตรสำหรับ 2-เมทิลเพนเทนที่แสดงในรูปที่ 2 มีอะตอมของคาร์บอนทั้งหมดหกอะตอมและเป็นไอโซเมอร์เฮกเซน ชื่อ ‘2-เมทิลเพนเทน’ หมายความว่าสายโซ่เพนเทนมีหมู่เมทิลเชื่อมโยงที่ตำแหน่งของอะตอมของคาร์บอนตัวที่สอง จำนวนไอโซเมอร์โครงสร้างที่เป็นไปได้จะเพิ่มขึ้นตามจำนวนคาร์บอนที่เพิ่มขึ้น ตัวอย่างเช่น เฮกเซนสามารถมีโครงสร้างของไอโซเมอร์ที่แตกต่างกันได้ 5 ไอโซเมอร์ ออกเทนมีความเป็นไปได้ดังกล่าว 18 ชนิด และเฮกเซนมากถึง 75
-
ไซคลิกไฮโดรคาร์บอน: ไซโคลแอลเคน, อะลิไซคลิกไฮโดรคาร์บอน
เป็นไปได้ที่จะปิดโครงสร้างโซ่ในขณะที่สร้างวงแหวนที่ประกอบด้วยองค์ประกอบ –CH 2 ที่ทำซ้ำ ชื่อนี้ตั้งตามชื่อของอัลเคนที่มีคำนำหน้าว่า ‘cyclo-‘ เช่น cyclobutane หรือ cycloheptane เพื่อให้ง่ายขึ้น สามารถแสดงเป็นรูปหลายเหลี่ยมปกติได้ 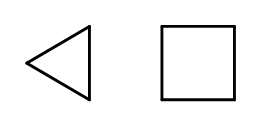 รูปที่ 3 จากซ้าย: ไซโคลโพรเพน, ไซโคลบิวเทน นอกจากนี้ยังมีวงแหวนสำรองซึ่งมีชื่อรวมถึงหมู่แทนที่ด้วย ในกรณีนี้ จำนวนอะตอมของคาร์บอนได้รับการออกแบบในลักษณะที่ตำแหน่งขององค์ประกอบแทนที่อาจต่ำ
รูปที่ 3 จากซ้าย: ไซโคลโพรเพน, ไซโคลบิวเทน นอกจากนี้ยังมีวงแหวนสำรองซึ่งมีชื่อรวมถึงหมู่แทนที่ด้วย ในกรณีนี้ จำนวนอะตอมของคาร์บอนได้รับการออกแบบในลักษณะที่ตำแหน่งขององค์ประกอบแทนที่อาจต่ำ
ตัวแทนที่สำคัญที่สุด
มีเทนเป็นสารประกอบที่มีสูตรโมเลกุล CH 4 ซึ่งเป็นจุดเริ่มต้นของชุดแอลเคนที่คล้ายคลึงกัน คาร์บอนเป็นสารเตตระวาเลนต์ ดังนั้นจึงมีพันธะ CH สี่พันธะ ที่อุณหภูมิห้อง จะเป็นก๊าซที่ไม่มีกลิ่นและไม่มีสี เมื่ออะตอมของคาร์บอนแสดงการไฮบริไดเซชันของ sp 3 จึงมีโครงสร้างเป็นรูปจัตุรมุข และออร์บิทัลที่ผลิตได้จะสร้างพันธะที่เท่ากันร่วมกับอะตอมของไฮโดรเจนสี่อะตอม อีเทนเป็นแอลเคนถัดไปในอนุกรม ซึ่งมีสูตรโมเลกุลคือ C 2 H 6 เมื่อดูสูตรกึ่งโครงสร้าง H 3 C-CH 3 เราจะสังเกตเห็นว่าแต่ละอะตอมของคาร์บอนเชื่อมโยงกับไฮโดรเจนสามอะตอม เช่นเดียวกับมีเธนและไฮโดรคาร์บอนระดับล่างอื่นๆ มันเป็นก๊าซที่ไม่มีสีและไม่มีกลิ่น พันธะ CH คือพันธะ frontal sigma sp-s ในขณะที่พันธะเดี่ยวระหว่างอะตอมของคาร์บอนคือพันธะ frontal sigma sp-sp
การสังเคราะห์แอลเคน
- การเติมไฮโดรเจนของ อัลคีน หรืออั ลไคน์

- การไฮโดรไลซิสของสารประกอบกริกนาร์ด
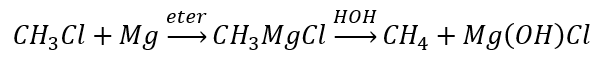
- การลดลงของอัลคิลเฮไลด์
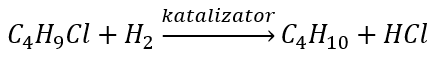
- ปฏิกิริยาของ Wurtz
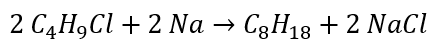
การลดลงของอัลดีไฮด์และคีโตน
- การลดลงของเคลมเมนเซ่น
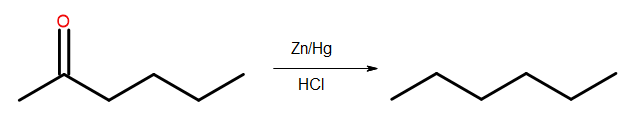 รูปที่ 4 ไดอะแกรมของการลดลงของ Clemmensen
รูปที่ 4 ไดอะแกรมของการลดลงของ Clemmensen
- ปฏิกิริยาของวูล์ฟ-คิชเนอร์
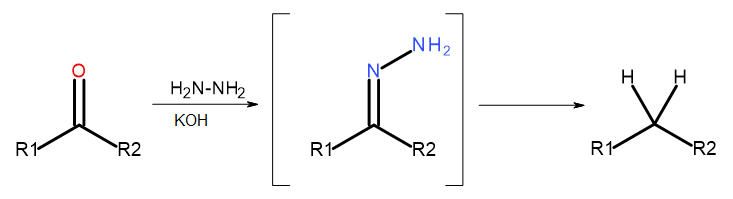 รูปที่ 5 ไดอะแกรมของ Wolff-Kishner
รูปที่ 5 ไดอะแกรมของ Wolff-Kishner
คุณสมบัติทางเคมีฟิสิกส์ของอัลเคน
แอลเคนสายสั้นตั้งแต่ C 1 ถึง C 4 ที่อุณหภูมิห้องเป็นก๊าซ ความคล้ายคลึงกันอื่น ๆ (เริ่มต้นจากเพนเทน) เป็นของเหลวที่มีจุดเดือดเพิ่มขึ้น กิ่งก้านที่มีอยู่ในโครงสร้างส่งผลให้จุดเดือดของไอโซเมอร์ต่ำลง การพึ่งพาการเพิ่ม –CH 2 อีกกลุ่มในโครงสร้างทำให้จุดเดือดสูงขึ้นประมาณ 20–30 o C พร้อมกับเพิ่มความยาวของโซ่คาร์บอน สถานะของการรวมตัวของแอลเคนตั้งแต่ออกตาดีเคนขึ้นไปเป็นของแข็งโดยมีจุดหลอมเหลวเริ่มต้นที่ 28 o C สำหรับ n-ออกตาดีเคน ไฮโดรคาร์บอนที่เป็นของแข็งรวมถึงพาราฟิน ในขณะที่ไฮโดรคาร์บอนที่เป็นของเหลวสูงกว่ารวมถึงน้ำมันพาราฟิน เนื่องจากธรรมชาติไม่ชอบน้ำ โมเลกุลของอัลเคนจึงไม่ผสมกับน้ำ ไม่เปียกน้ำ และไม่ละลายในน้ำ อย่างไรก็ตาม ด้วยความสัมพันธ์กับลักษณะที่ไม่มีขั้ว พวกมันจึงละลายในตัวเองได้ง่ายและในตัวทำละลายอินทรีย์ที่ไม่มีขั้ว ปานกลาง และต่ำที่คล้ายกัน ความสามารถในการละลายของแอลเคนในตัวทำละลายแอลกอฮอล์ที่ได้รับความนิยม 2 ชนิด (เมทานอลและเอทานอล) นั้นค่อนข้างดี ในเมทานอล แอลเคนจะละลายได้ดีจนถึงความเข้มข้นที่กำหนดเท่านั้น ความเข้มข้นที่มากเกินไปทำให้เฟสแยกจากกัน ในเอทานอล อัลเคนที่ต่ำกว่าจะละลายได้ง่ายมาก ในขณะที่อัลเคนที่สูงกว่าจะละลายได้ยากกว่าเล็กน้อย สารไฮโดรคาร์บอนที่สูงขึ้นเป็นสารไวไฟ ไฮโดรคาร์บอนที่เป็นก๊าซและไฮโดรคาร์บอนที่เป็นของเหลวเป็นคู่จะเกิดของผสมที่มีศักยภาพในการระเบิดเมื่อผสมกับอากาศ ปฏิกิริยาของอัลเคนค่อนข้างต่ำเนื่องจากไม่มีหมู่ฟังก์ชันที่อาจทำปฏิกิริยาได้ พันธะระหว่างอะตอมของคาร์บอน (CC) และพันธะระหว่างอะตอมของคาร์บอนและออกซิเจน (CH) มีความทนทานต่อการแตกแยกสูง พลังงานของพันธะเหล่านี้คือ 88 กิโลแคลอรี/โมล และ 104 กิโลแคลอรี/โมล ตามลำดับ พวกเขาอาจตอบสนองทันทีในบางเงื่อนไขเท่านั้น
ปฏิกิริยาของแอลเคน
- การเผาไหม้ที่สมบูรณ์ – ด้วยการปล่อยก๊าซคาร์บอนไดออกไซด์
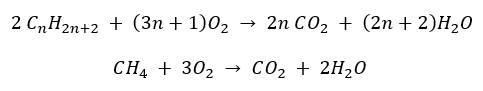
- กึ่งเผาไหม้ – มีออกซิเจนจำกัดและปล่อยก๊าซคาร์บอนมอนอกไซด์
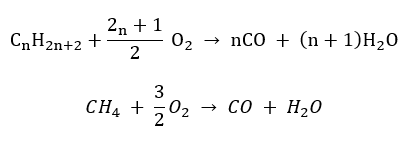
- การเผาไหม้ที่ไม่สมบูรณ์ – คาร์บอนแบล็คเกิดขึ้นจากปริมาณออกซิเจนที่จำกัดมาก
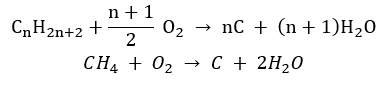
- ปฏิกิริยาของการแทนที่ (ฮาโลจิเนชันเชิงอนุมูล เป็นตัวอย่างโดยปฏิกิริยาของมีเทนกับคลอรีนโดยมีส่วนร่วมของแสง)
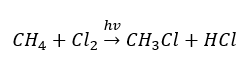
- ไพโรไลซิสคือการสลายตัวของแอลเคนให้เป็นโมเลกุลที่เล็กลงที่อุณหภูมิสูงมาก ขึ้นอยู่กับกระบวนการ อาจเกิดการแตกร้าว การแตกร้าวด้วยน้ำ หรือไอโซเมอไรเซชัน
- ไนเตรตโดยใช้กรดไนตริก (V) และการก่อตัวของส่วนผสมของผลิตภัณฑ์: ไอโซเมอร์ที่มีหมู่แทนที่ –NO 2 ในตำแหน่งต่างๆ
- ซัลโฟเนชันแบบสองขั้นตอน โดยที่เมอร์โซลเป็นผลิตภัณฑ์ระดับกลางและเมอร์โซลเป็นผลิตภัณฑ์ขั้นสุดท้าย
