ในวิชาเคมี สารประกอบเคมีบางชนิดจะสร้างพันธะพิเศษกับโมเลกุลของน้ำ สิ่งเหล่านี้ไม่ใช่พันธะเคมี แต่เป็นปฏิกิริยาระยะสั้นที่กำหนดคุณสมบัติของสารประกอบเหล่านี้โดยเฉพาะ เรากำลังพูดถึงไฮเดรต คุณสมบัติเหล่านี้พร้อมใช้งานในภาคอุตสาหกรรมที่เลือก เกลือไฮเดรตที่ได้รับความนิยมมากที่สุดคือยิปซั่มหรือแคลเซียมซัลเฟตไดไฮเดรต (VI) ซึ่งเป็นวัตถุดิบสำคัญในอุตสาหกรรมการก่อสร้างอย่างไม่ต้องสงสัย ไฮเดรตยังเป็นตัวบ่งชี้ปริมาณความชื้นได้ดีมาก สิ่งนี้เกี่ยวข้องกับความจริงที่ว่าสีของเกลือปราศจากน้ำมักจะแตกต่างจากเกลือไฮเดรต

ให้ความชุ่มชื้น
ไฮเดรตไม่ใช่สารประกอบทางเคมีที่เกิด พันธะเคมี เช่น พันธะโควาเลนต์ เกิดขึ้นระหว่างโมเลกุลของน้ำกับโมเลกุลของเกลือที่กำหนด พวกมันไม่ใช่สารประกอบประสานงานด้วย การก่อตัวของพันธะไฮโดรเจนซึ่งมีความแข็งแรงน้อยกว่าพันธะเคมีมากเป็นลักษณะเฉพาะของโครงสร้างเหล่านี้ ไฮเดรตมีโครงสร้างเป็นรูปตาข่ายคริสตัล โมเลกุลของน้ำมีการกระจายอย่างไม่สม่ำเสมอ มักใช้คำว่า "น้ำแห่งการตกผลึก" ไฮเดรตได้มาจากการ ให้ความชุ่มชื้น โมเลกุลของเกลือ โดยเฉพาะอนุพันธ์ของกรดอนินทรีย์ มีแนวโน้มที่จะเกิดปฏิกิริยานี้มากที่สุด ไฮเดรชั่นเกี่ยวข้องกับการเปลี่ยนแปลงของผลึกแอนไฮดรัสให้เป็นผลึกไฮเดรต อาจทำให้เกิดการเปลี่ยนแปลงมวลแร่ แต่ไม่ทำลายมัน การให้น้ำมักเกิดร่วมกับกระบวนการอื่นๆ เช่น คาร์บอนไดออกไซด์ สารเคมีที่ให้ความชุ่มชื้นภายใต้สภาวะปกติจะมีคุณลักษณะพิเศษคือ สามารถดูดความชื้นได้สูง กล่าวคือ มีความสัมพันธ์กันอย่างมากกับโมเลกุลของน้ำ สารดังกล่าวมีความสามารถใน การดูดซับความชื้นจากอากาศ เป็นต้น อีกวิธีหนึ่งในการรับไฮเดรตคือการ ตกผลึกจากสารละลายที่เป็นน้ำ สูตรโมเลกุลของไฮเดรตเกิดขึ้นจากการเขียนสูตรเกลือและระบุจำนวนโมเลกุลของน้ำไฮเดรต เพื่อให้เป็นสัญลักษณ์ทั่วไป ตัวอักษร ‘n’ จะถูกวางไว้หน้า ‘H 2 O’ ค่าของมันมากกว่าหนึ่งและสอดคล้องกับจำนวนโมเลกุลของน้ำที่ติดอยู่ ความแตกต่างที่พบบ่อยที่สุดคือระหว่างไฮเดรตที่มี n=½ (เฮมิไฮเดรต), n= 1 (โมโนไฮเดรต), n=2 (ไดไฮเดรต) และ n=3 (ไตรไฮเดรต) ที่สำคัญสารชนิดเดียวกันสามารถเกาะติดโมเลกุลของน้ำได้จำนวนต่างกัน ![]()
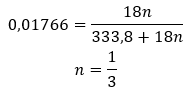 เนื่องจากมี พันธะไฮโดรเจน ระหว่างโมเลกุลของเกลือและโมเลกุลของน้ำ สารประกอบเหล่านี้จึงไม่แสดงความต้านทานต่ออุณหภูมิที่สูงขึ้นได้อย่างน่าพอใจ เมื่อถูกความร้อนจะสลายตัวและเปลี่ยนเป็นรูปแบบปราศจากน้ำ ไฮเดรตละลายได้ดีมากในน้ำ ในสารละลายที่เป็นน้ำ โมเลกุลของน้ำไฮเดรตที่ติดอยู่กับเกลือจะถูกปล่อยออกมา ควรคำนึงถึงข้อเท็จจริงนี้เมื่อทำการแก้ปัญหาของสารเหล่านี้ การไม่คำนึงถึงระดับความชุ่มชื้นของสารประกอบที่กำหนดจะส่งผลให้เกิดข้อผิดพลาด หากเพียงแต่ในการกำหนดความเข้มข้นของสารละลายเท่านั้น ลักษณะสำคัญของเกลือไฮเดรตคือ การเปลี่ยนสี เนื่องจากการเกาะตัวของโมเลกุลของน้ำในปฏิกิริยาไฮเดรชั่น ควรสังเกตว่ารูปแบบไฮเดรตแสดงการดูดความชื้นน้อยกว่าอย่างมีนัยสำคัญเมื่อเปรียบเทียบกับเกลือปราศจากน้ำ
เนื่องจากมี พันธะไฮโดรเจน ระหว่างโมเลกุลของเกลือและโมเลกุลของน้ำ สารประกอบเหล่านี้จึงไม่แสดงความต้านทานต่ออุณหภูมิที่สูงขึ้นได้อย่างน่าพอใจ เมื่อถูกความร้อนจะสลายตัวและเปลี่ยนเป็นรูปแบบปราศจากน้ำ ไฮเดรตละลายได้ดีมากในน้ำ ในสารละลายที่เป็นน้ำ โมเลกุลของน้ำไฮเดรตที่ติดอยู่กับเกลือจะถูกปล่อยออกมา ควรคำนึงถึงข้อเท็จจริงนี้เมื่อทำการแก้ปัญหาของสารเหล่านี้ การไม่คำนึงถึงระดับความชุ่มชื้นของสารประกอบที่กำหนดจะส่งผลให้เกิดข้อผิดพลาด หากเพียงแต่ในการกำหนดความเข้มข้นของสารละลายเท่านั้น ลักษณะสำคัญของเกลือไฮเดรตคือ การเปลี่ยนสี เนื่องจากการเกาะตัวของโมเลกุลของน้ำในปฏิกิริยาไฮเดรชั่น ควรสังเกตว่ารูปแบบไฮเดรตแสดงการดูดความชื้นน้อยกว่าอย่างมีนัยสำคัญเมื่อเปรียบเทียบกับเกลือปราศจากน้ำ
ไฮเดรตของสารประกอบอนินทรีย์
เกลือ ของ กรดอนินทรีย์ เป็นสารที่มีแนวโน้มที่จะสร้างไฮเดรตด้วยโมเลกุลของน้ำมากที่สุด ไฮเดรตที่พบมากที่สุดของสารประกอบอนินทรีย์ ได้แก่:
- คอปเปอร์ (II) ซัลเฟตไฮเดรต (VI), CuSO 4 – คอปเปอร์ (II) ซัลเฟต (VI) ใช้ระดับการให้ความชุ่มชื้นที่หลากหลาย จำนวนโมเลกุลน้ำที่ติดอยู่สูงสุดคือห้าโมเลกุล ผลจากการให้ความร้อนแก่เพนตะไฮเดรตของเกลือนี้ โมเลกุลของน้ำจึงหลุดออกไป สองตัวแรกและไตรไฮเดรตเกิดขึ้น และเมื่อระบบให้ความร้อนต่อไป ก็จะได้คอปเปอร์ (II) ซัลเฟตโมโนไฮเดรต (VI) ในการกำจัดโมเลกุลน้ำสุดท้าย จำเป็นต้องให้ความร้อนแก่สารประกอบที่อุณหภูมิมากกว่า 200 ᵒC คอปเปอร์ (II) ซัลเฟตไฮเดรต (VI) มีสีฟ้า ซึ่งเกิดจากการมีน้ำตกผลึกอยู่รอบๆ ไอออนของทองแดง ในขณะที่เกลือปราศจากน้ำจะมีสีขาว ความสามารถในการดูดความชื้นสูงและความสามารถในการสร้างไฮเดรตนั้นใช้เพื่อขจัดความชื้นออกจากของเหลวบางชนิด
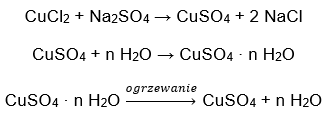
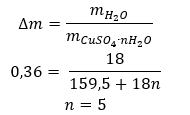
- โคบอลต์ (II) คลอไรด์ไฮเดรต, CoCl 2 – โคบอลต์ปราศจากน้ำ (II) คลอไรด์สามารถดูดความชื้นได้สูง ด้วยความสัมพันธ์อันดีกับโมเลกุลของน้ำ จึงสามารถดูดซับความชื้นได้แม้กระทั่งจากอากาศ กระบวนการนี้ส่งผลให้เกิดการสร้างไฮเดรตของเกลือนี้ รูปแบบไฮเดรตที่พบมากที่สุดคือโคบอลต์ (II) คลอไรด์เฮกซาไฮเดรต – CoCl 2 * 6H 2 อีกรูปแบบหนึ่งคือโมเลกุลไดไฮเดรต เกลือนี้ยังแสดงความสามารถในการเปลี่ยนสีตามปริมาณความชื้น เกลือแอนไฮดรัสเป็นสีน้ำเงิน ไดไฮเดรตมีสีม่วงอมชมพู และสีของโมเลกุลเฮกซะไฮเดรตเป็นสีแดงเข้ม
- โซเดียมซัลเฟตไฮเดรต (VI), นา 2 SO 4 – เกลือนี้มีอยู่ในรูปของไฮเดรตสองชนิด: เฮปตาไฮเดรต (โมเลกุลของน้ำห้าโมเลกุลในโครงสร้าง) และเดคาไฮเดรต (โมเลกุลของน้ำสิบโมเลกุลในโครงสร้าง) โซเดียมซัลเฟต (VI) ในรูปแบบปราศจากน้ำเกิดขึ้นในธรรมชาติในรูปของแร่เธนาร์ไดต์ที่หายาก โซเดียมซัลเฟตสิบไฮเดรต (VI) เป็นสิ่งที่เรียกว่าเกลือของ Glauber มีการใช้กันอย่างแพร่หลายในการผลิตแก้ว กระดาษ น้ำยาซักผ้า และโซดา เกลือของ Glauber ยังเป็นหนึ่งในส่วนผสมที่จำเป็นสำหรับการผลิตอุลตรามารีนเม็ดสีฟ้า นอกจากนี้สารประกอบนี้ยังมีผลในการรักษาระบบย่อยอาหารเนื่องจากมีคุณสมบัติเป็นยาระบาย

ยิปซั่ม
ตัวอย่างของเกลืออนินทรีย์ไฮเดรตที่มีความสำคัญระดับโลกและมีการนำไปใช้อย่างกว้างขวางคือยิปซั่ม เป็นแร่ธาตุที่ประกอบด้วยแคลเซียมซัลเฟต (VI), CaSO 4 ในรูปแบบไฮเดรต ยิปซั่มผลึกคือไดไฮเดรตของเกลือนี้ ภายใต้สภาพธรรมชาติ มันจะเกิดขึ้นในระหว่างการระเหยของน้ำเกลือจากทะเลสาบและแม่น้ำ ที่อุณหภูมิต่ำกว่า 42ᵒC แอนไฮดรัสแคลเซียมซัลเฟต (VI) คือแอนไฮไดรต์ เรียกอีกอย่างว่ายิปซั่มปราศจากน้ำ ในทางกลับกัน การสร้างยิปซั่มคือแคลเซียมซัลเฟตเฮมิไฮเดรต (VI) เกลือรูปแบบใดที่ได้จะขึ้นอยู่กับอุณหภูมิที่เกิดขึ้นระหว่างการแปรรูปหินตะกอนต้นกำเนิด ยิปซั่มที่ใช้ในการก่อสร้างมักมีส่วนผสมของเกลือปูนไฮเดรตรูปแบบต่างๆ 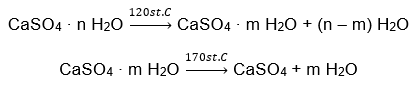
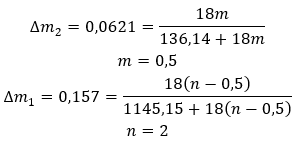 ความเป็นไปได้ในการใช้งานยิปซั่มนั้นกว้างมาก โดยเฉพาะอย่างยิ่งในอุตสาหกรรมการก่อสร้าง การใช้เกลือไฮเดรตที่สำคัญที่สุดมีดังต่อไปนี้:
ความเป็นไปได้ในการใช้งานยิปซั่มนั้นกว้างมาก โดยเฉพาะอย่างยิ่งในอุตสาหกรรมการก่อสร้าง การใช้เกลือไฮเดรตที่สำคัญที่สุดมีดังต่อไปนี้:
- ในอุตสาหกรรมการก่อสร้างยิปซั่มถูกนำมาใช้ในการตกแต่งองค์ประกอบ เป็นหนึ่งในส่วนประกอบของผลิตภัณฑ์กึ่งสำเร็จรูปแบบหลวม มอร์ตาร์ กาว สารเคลือบยิปซั่ม และส่วนประกอบประกอบสำเร็จรูป เช่น แผ่นยิปซั่ม
- ยาใช้พลาสเตอร์เพื่อพยุงแขนขาที่หัก ผ้าพันแผลยิปซั่มถือว่าเป็นมิตรกับผิวหนัง นอกจากนี้ วัสดุนี้ยังใช้ในห้องปฏิบัติการเทคโนโลยีทันตกรรมอีกด้วย
- อุตสาหกรรมนี้ใช้ยิปซั่มในการสร้างแบบจำลองและการประชุมเชิงปฏิบัติการการออกแบบ ปูนปลาสเตอร์มีความเหมาะสมมากสำหรับการสร้างวัตถุที่เป็นประโยชน์ต่างๆ
- ยิปซั่มเป็นสารเติมแต่งให้กับ ปุ๋ย บางชนิดที่ใช้ในการเกษตร

มีเทนคลาเทรต
มีเทนคลาเทรตอยู่ในกลุ่มของสารประกอบที่เรียกว่า แก๊สไฮเดรต พวกเขารับผิดชอบต่อการเปลี่ยนแปลงสภาพภูมิอากาศอย่างรวดเร็วส่วนใหญ่ในประวัติศาสตร์โลก คลาเทรตมีเทนมักเรียกกันว่ามีเทนไฮเดรตหรือมีเทนน้ำแข็ง พวกมันก่อตัวเป็นน้ำและ มีเทน ในรูปแบบของแข็ง โมเลกุลของพวกมันมีความโดดเด่นด้วยโครงสร้างผลึก พวกมันถูกสร้างขึ้นภายใต้แรงกดดันที่เพิ่มขึ้น พวกมันอยู่ในรูปของของแข็งสีขาวไม่มีกลิ่น ซึ่งมักจะมีลักษณะคล้ายกันในแง่ของรูปลักษณ์ภายนอกเป็นน้ำแข็ง สิ่งที่น่าสนใจคือเมื่อสัมผัสแล้วจะมีลักษณะคล้าย โพลีสไตรีน Clathrates เป็นกลุ่มสารเคมีที่มีลักษณะเฉพาะ โมเลกุลของน้ำสร้างโครงสร้างที่มีลักษณะคล้ายกรง มีเทนถูกเก็บไว้ในกรงนี้ ที่สำคัญสารทั้งสองชนิดนี้ไม่ก่อให้เกิดพันธะเคมีต่อกัน โดยทั่วไป คลาเทรตมีเทนประกอบด้วยโมเลกุลของน้ำ 46 โมเลกุลรอบๆ กรงขนาดเล็ก 2 กรงและขนาดกลาง 6 กรง โมเลกุลมีเทนติดอยู่ข้างใน เป็นที่รู้กันว่าคลาเทรตประกอบด้วยโมเลกุลของน้ำ 136 โมเลกุล โดยมีก๊าซมีเทนขนาดเล็ก 16 และกรงใหญ่แปดกรงอยู่ภายใน ในช่วงไม่กี่ปีที่ผ่านมา มีการค้นพบทรัพยากรนี้จำนวนมากที่ก้นมหาสมุทร กำลังดึงดูดความสนใจอย่างมากเนื่องจากมีศักยภาพในการสกัดมีเทนในปริมาณมาก ซึ่งสามารถนำมาใช้เพื่อวัตถุประสงค์ด้านพลังงานได้ สารมีเทนที่ลุกไหม้ด้วยเปลวไฟสม่ำเสมอมีสีแดง หลังจากการเผาไหม้แล้วยังมีน้ำหลอมเหลวหลงเหลืออยู่ มีเทนที่สกัดด้วยวิธีนี้อาจเป็นทางเลือกที่ดีแทนแหล่ง ไฮโดรคาร์บอน ทั่วไป แต่ก็ค่อนข้างเป็นภัยคุกคามต่อสภาพภูมิอากาศเช่นกัน ยังมีความรู้ไม่เพียงพอเกี่ยวกับการใช้ประโยชน์จากมีเทนจากคลาเทรตที่สะสมอยู่บนพื้นมหาสมุทร การปล่อยก๊าซในปริมาณมากที่ไม่สามารถควบคุมได้อาจเป็นอันตรายได้ เนื่องจากจะทำให้เกิดภาวะเรือนกระจกรุนแรงกว่าคาร์บอนไดออกไซด์มาก
























































































































