ตามคำนิยาม กิจกรรมทางเคมีคือความสามารถขององค์ประกอบในการบริจาคอิเล็กตรอนในปฏิกิริยาเคมี ในทางปฏิบัติ กิจกรรมของพวกมันจะเพิ่มขึ้นตามอิเลคโตรเนกาติวีตี้ที่ลดลง ซึ่งเป็นการวัดความสามารถขององค์ประกอบในการดึงดูดอิเล็กตรอน หากโลหะไม่ดึงดูดอิเล็กตรอนอย่างรุนแรง โลหะนั้นจะเกิดปฏิกิริยามากขึ้น ธาตุอ้างอิงคือไฮโดรเจน ใช้ในการจำแนกกิจกรรมทางเคมีของโลหะ การวัดกิจกรรมของโลหะคือความสามารถในการแทนที่ไฮโดรเจนจากกรดหรือไฮโดรเจนจากโมเลกุลของน้ำ

ชุดกิจกรรมทางเคมีของโลหะ
คำนี้ใช้เพื่ออธิบายบทสรุปขององค์ประกอบทางเคมีที่ มีลักษณะเป็นโลหะ ตามลำดับเฉพาะจากที่มีฤทธิ์ทางเคมีน้อยที่สุดไปมากที่สุด ใช้เพื่อเปรียบเทียบกิจกรรมของโลหะชนิดต่างๆ นอกจากโลหะแล้ว ชุดกิจกรรมทางเคมียังรวม ไฮโดรเจนที่ไม่ใช่โลหะ ซึ่งเป็นองค์ประกอบอ้างอิงด้วย ยิ่งโลหะมีลำดับกิจกรรมสูงเท่าใด ก็ยิ่งเกิดปฏิกิริยามากขึ้นเท่านั้น นอกจากนี้ยังเกี่ยวข้องกับข้อเท็จจริงที่ว่ามันออกซิไดซ์ได้ง่ายกว่า ดังนั้นจึงเป็นรีดักท์ที่แรงกว่าและเป็นองค์ประกอบที่มีฤทธิ์ทางเคมีมากกว่า ในทางตรงกันข้าม ยิ่งโลหะวางอยู่ในลำดับกิจกรรมที่ต่ำกว่า ปฏิกิริยาก็จะยิ่งน้อยลงเท่านั้น ซึ่งหมายความว่าจะเกิดปฏิกิริยารีดักชันได้ง่ายขึ้น ดังนั้นจึงเป็นสารออกซิแดนท์ที่แรงกว่าและเป็นองค์ประกอบที่ทำงานน้อย จากการใช้ค่าที่แสดงในตารางที่ 1 เราจะเห็นว่ายิ่งค่าศักย์มาตรฐานขององค์ประกอบมีค่าต่ำลง สารรีดักท์ก็จะยิ่งแข็งแกร่งขึ้นและมีปฏิกิริยาทางเคมีกับโลหะมากขึ้นเท่านั้น การวัดความสามารถในการบริจาคอิเล็กตรอนในกิจกรรมของโลหะหลายประเภทคือค่าศักย์มาตรฐานของพวกมัน สำหรับไฮโดรเจนหรืออิเล็กโทรดไฮโดรเจน ค่าศักย์ไฟฟ้ามาตรฐานจะถือว่าเป็นศูนย์ ศักย์ไฟฟ้ามาตรฐานคือแรงเคลื่อนไฟฟ้าของเซลล์ที่ประกอบด้วยครึ่งเซลล์ไฮโดรเจนมาตรฐานและอีกครึ่งเซลล์มาตรฐาน ซึ่งมีความเข้มข้นของสารตั้งต้นและผลิตภัณฑ์เป็น 1 โมล/ลูกบาศก์เมตร 3
| อิเล็กโทรด | ศักยภาพมาตรฐาน [V] |
| ลี่/ลี่ + | -3.04 |
| Ca/Ca 2+ | -2.86 |
| มก./มก . 3+ | -2.36 |
| อัล/อัล 3+ | -1.69 |
| นาที/นาที 2+ | -1.18 |
| สังกะสี/สังกะสี 2+ | -0.76 |
| Cr/Cr3 + | -0.74 |
| เฟ/เฟ 2+ | -0.44 |
| ซีดี/ซีดี 2+ | -0.40 |
| โค/โค 2+ | -0.28 |
| นิ/นิ 2+ | -0.26 |
| Sn/Sn 2+ | -0.14 |
| Pb/Pb 2+ | -0.14 |
| เฟ/เฟ 3+ | 0.04 |
| ชม. 2 /2ชม . + | 0.00 |
| ไบ/ไบ 3+ | +0.32 |
| Cu/Cu 2+ | +0.34 |
| เอจี/เอจี + | +0.80 |
| ปรอท/ปรอท 2+ | +0.85 |
| ออสเตรเลีย/ออสเตรเลีย 3+ | +1.52 |
ตาราง ที่ 1 . ซีรีส์เคมีไฟฟ้าของโลหะ โลหะที่มองเห็นได้ที่ด้านบนของซีรีส์นั้นมีการใช้งานมากที่สุด ไฮโดรเจนที่อยู่เหนือมีแนวโน้มที่จะออกซิไดซ์ได้ง่ายดังนั้นจึงมีสารรีดิวซ์ที่แรงกว่าไฮโดรเจน องค์ประกอบที่อยู่ต่ำกว่าไฮโดรเจนในซีรีส์นี้จะลดลงได้ง่ายกว่าและเป็นสารออกซิไดซ์ที่แรงกว่า หากโลหะมีศักยภาพเชิงลบมากกว่าโลหะอื่น นั่นหมายความว่าโลหะนั้นจะแทนที่มันจากเกลือ ตัวอย่างเช่น เหล็กจะแทนที่ทองแดงในเกลือของทองแดง แต่ทองแดงจะไม่แทนที่เหล็กจากเกลือของมัน แต่สามารถแทนที่เงินจากเกลือเงินได้ ลิเธียมและเบริลเลียมจากสารละลายเกลือของโลหะอื่น ๆ จะไม่แทนที่พวกมัน แต่ทำปฏิกิริยาโดยตรงกับน้ำ พวกมันแทนที่ไฮโดรเจนและผลิตสารประกอบของพวกมัน – ไฮดรอกไซด์ โลหะดังกล่าวเรียกว่าโลหะแอคทีฟ กิจกรรมของโลหะและตารางธาตุขององค์ประกอบ เช่นเดียวกับคุณสมบัติอื่นๆ กิจกรรมทางเคมีขององค์ประกอบสามารถอนุมานได้จาก ตำแหน่งใน ตารางธาตุ โลหะที่ออกฤทธิ์มากที่สุดคือโลหะที่อยู่ในกลุ่ม I และ II เนื่องจากสามารถแทนที่ไฮโดรเจนจากน้ำเพื่อสร้างไฮดรอกไซด์ได้อย่างง่ายดาย ในกลุ่ม กิจกรรมทางเคมีของโลหะจะเพิ่มขึ้นตาม เลขอะตอม ที่เพิ่มขึ้น คาบจะลดลงเมื่อเลขอะตอมเพิ่มขึ้น 
โลหะมีค่าและโลหะฐาน
ไฮโดรเจนไม่เพียงแต่ให้จุดอ้างอิงของกิจกรรมเท่านั้น แต่ยัง แยกโลหะมีค่าและโลหะฐานออกจากอนุกรม ด้วย โลหะฐานคือโลหะที่อยู่เหนือไฮโดรเจน แต่ละตัวทำปฏิกิริยากับกรดโดยแทนที่ไฮโดรเจนจากพวกมัน ตั้งแต่โพแทสเซียมไปจนถึงแคลเซียมพวกมันจะทำปฏิกิริยากับน้ำที่อุณหภูมิห้องอยู่แล้ว และจากแมกนีเซียมไปจนถึงเหล็กพวกมันจะทำปฏิกิริยากับน้ำที่อุณหภูมิสูงขึ้น โลหะทุกชนิดที่อยู่ต่ำกว่าไฮโดรเจนในชุดกิจกรรม จะไม่แทนที่ไฮโดรเจนจากกรด อย่างไรก็ตาม พวกมันสามารถทำปฏิกิริยากับกรดออกซิไดซ์เพื่อสร้าง เกลือ และ ออกไซด์ ที่สอดคล้องกัน ซึ่งเกิดขึ้นจากการลดกรดที่ตกค้าง องค์ประกอบที่อยู่ด้านล่างสุดของซีรีส์นี้ ตั้งแต่เงินไปจนถึงทอง มี ความทนทานต่อปฏิกิริยาเคมีสูงจนทำปฏิกิริยากับ อะควารีเจีย เท่านั้น สารละลายดังกล่าวเป็น ส่วนผสม ของสารละลายเข้มข้นของ กรดไฮโดรคลอริก และสารละลายเข้มข้นของ กรดไนตริก (V) ผสมในอัตราส่วนปริมาตร 3:1 เมื่อทราบข้อเท็จจริงเหล่านี้ เราสามารถอนุมานได้ว่าสามารถทำปฏิกิริยาหลายอย่างเพื่อแยกแยะกิจกรรมของธาตุได้ เช่น ด้วยน้ำที่อุณหภูมิห้อง น้ำร้อน กรดที่ไม่ออกซิไดซ์ กรดออกซิไดซ์ และกรดกัดทอง
การทดลองเพื่อตรวจจับโลหะที่แทนที่ไฮโดรเจนจากกรด
วิธีที่ง่ายที่สุดในการยืนยันกิจกรรมของโลหะคือทำการทดลอง ในการดำเนินการนี้ ควรเตรียมหลอดทดลองจำนวน 10 หลอด โดยจะวางสิ่งต่อไปนี้ตามลำดับ: ใน 1-5: ริบบิ้นแมกนีเซียม ลวดสังกะสี ลวดเหล็ก ลวดนิกเกิล และลวดทองแดง ควรทำซ้ำลำดับเดียวกันในหลอด 6-10 เติมกรดไฮโดรคลอริก 2-3 มิลลิลิตรลงในหลอด 1-5 และ กรดซัลฟิวริก เจือจาง (VI) 2-3 มิลลิลิตรลงในหลอด 6-10 ใช้เฝือกที่ไหม้กับแต่ละหลอด ในหลอดทดลองที่ประกอบด้วยริบบิ้นแมกนีเซียมและเหล็ก ลวดสังกะสีและนิกเกิลที่เต็มไปด้วยกรดจะปล่อยฟองก๊าซออกมา การปลดปล่อยที่รุนแรงที่สุดสามารถสังเกตได้ในหลอดที่มีแมกนีเซียม ปฏิกิริยาที่เกิดขึ้นมีดังนี้: 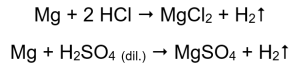 ปริมาณก๊าซที่ปล่อยออกมาลดลงตามลำดับ: สังกะสี เหล็ก นิกเกิล ปฏิกิริยาต่อไปนี้เกิดขึ้นตามลำดับ:
ปริมาณก๊าซที่ปล่อยออกมาลดลงตามลำดับ: สังกะสี เหล็ก นิกเกิล ปฏิกิริยาต่อไปนี้เกิดขึ้นตามลำดับ:  ในท่อที่ประกอบด้วยลวดทองแดง จะไม่เห็นก๊าซ ไม่มีการเปลี่ยนแปลง ซึ่งหมายความว่าจะไม่เกิดปฏิกิริยาดังกล่าว:
ในท่อที่ประกอบด้วยลวดทองแดง จะไม่เห็นก๊าซ ไม่มีการเปลี่ยนแปลง ซึ่งหมายความว่าจะไม่เกิดปฏิกิริยาดังกล่าว: 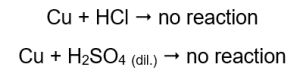 เมื่อใช้เฝือกที่ไหม้ จะได้ยินเสียงที่โดดเด่นในท่อที่มีการปล่อยก๊าซออกมา
เมื่อใช้เฝือกที่ไหม้ จะได้ยินเสียงที่โดดเด่นในท่อที่มีการปล่อยก๊าซออกมา
สรุปข้อสังเกตและข้อสรุป:
แมกนีเซียม สังกะสี เหล็ก และนิกเกิลทำปฏิกิริยากับทั้งกรดไฮโดรคลอริกและกรดซัลฟิวริก (VI) แต่ละตัวจะแทนที่ไฮโดรเจนจากกรด ซึ่งหมายความว่าพวกมันจะมีลำดับกิจกรรมของโลหะสูงกว่ากรด ปฏิกิริยาดังกล่าวทำให้เกิดผลิตภัณฑ์ในรูปของเกลือและก๊าซไฮโดรเจนซึ่งถูกปล่อยออกมา เสียงอันโดดเด่นที่มาพร้อมกับการใช้เฝือกเรืองแสงบนหลอดทดลองที่มีก๊าซหลบหนีนั้น เกิดจากปฏิกิริยาของไฮโดรเจนกับออกซิเจน ในบรรดาโลหะทั้งหมดที่ทดสอบ แมกนีเซียมเป็นสารที่มีปฏิกิริยามากที่สุด รองลงมาคือสังกะสี เหล็ก นิกเกิล และทองแดง เราบอกได้เพราะความเข้มของฟองก๊าซบ่งบอกถึงกิจกรรมของโลหะ ไม่พบการเปลี่ยนแปลงในท่อที่บรรจุทองแดง นี่แสดงให้เห็นว่าทองแดงไม่สามารถแทนที่ไฮโดรเจนจากกรดไฮโดรคลอริกหรือกรดซัลฟิวริกเจือจาง (VI) ได้
