ส่วนผสมที่เป็นเนื้อเดียวกันของสารอย่างน้อยสองชนิดถือเป็นวิธีแก้ปัญหา แม้ว่าเราคิดว่าสารละลายส่วนใหญ่เป็นของเหลว แต่ของผสมที่เป็นก๊าซและของแข็งก็เป็นสารละลายเช่นกัน อย่างไรก็ตาม ปฏิกิริยาเคมีกลุ่มใหญ่มาก ทั้งในห้องปฏิบัติการและในระดับอุตสาหกรรม เกิดขึ้นในสภาพแวดล้อมที่เป็นน้ำ สารละลายของเหลวมีสามประเภท – ตัวทำละลายเป็นของเหลวเสมอ แต่ตัวถูกละลายสามารถเป็นก๊าซ ของเหลว หรือของแข็งได้ ในบรรดาตัวอย่าง ได้แก่ สารละลายที่เป็นน้ำของไฮโดรเจนคลอไรด์ เอทานอล และเกลือในครัว

อธิบายส่วนประกอบของสารละลาย
คุณสมบัติที่สำคัญที่สุดของโซลูชันใด ๆ คือคำจำกัดความขององค์ประกอบ ความสามารถในการกำหนดองค์ประกอบของสารละลายและคำนวณใหม่โดยขึ้นอยู่กับหน่วยที่สนใจเป็นทักษะพื้นฐานของนักเคมีทุกคน ปริมาณของส่วนผสมที่กำหนดในของผสมสามารถกำหนดได้หลายวิธี เช่น โดยมวล ปริมาตร หรือโมลาริตี ด้วยเหตุนี้ จึงมีความเข้มข้นหลายประเภท ซึ่งกำหนดปริมาณของส่วนประกอบขึ้นอยู่กับปริมาณของสารละลายหรือของผสม บ่อยครั้งเมื่ออธิบายองค์ประกอบของสารละลาย เราใช้คำศัพท์: เศษส่วนมวล เศษส่วนปริมาตร เศษส่วนโมล และความเข้มข้นของโมลาร์ เศษส่วนระบุว่าส่วนใดของส่วนผสมที่กำหนดเป็นส่วนประกอบของดอกเบี้ย สามารถแสดงเป็นหน่วยของมวล ปริมาตร หรือโมลของสารประกอบ
ความเข้มข้นของโมลาร์
นี่คือความเข้มข้นที่เลือกบ่อยที่สุดเนื่องจากสะดวกในการใช้งานโดยกำหนดจำนวนโมลของสารที่มีอยู่ในปริมาตรของสารละลาย พื้นฐานทางทฤษฎีคือข้อความที่ว่าสารละลายของสารสองชนิดที่แตกต่างกันซึ่งมีความเข้มข้นและปริมาตรเท่ากัน ที่อุณหภูมิเดียวกัน มีจำนวนโมลเท่ากัน ดังนั้นจำนวนโมเลกุลของตัวถูกละลายจึงเท่ากัน บนพื้นฐานของความสัมพันธ์นี้ สำหรับสารละลายที่มีความเข้มข้นของโมลเท่ากัน สามารถผสมสารละลายในปริมาตรที่เหมาะสมเพื่อให้ได้สัดส่วนที่ถูกต้องของจำนวนโมลที่กำหนดโดยสัมประสิทธิ์ปริมาณสัมพันธ์ ซึ่งหมายความว่าหากนึกถึงปฏิกิริยาประเภท A + B → C โดยที่สาร A หนึ่งโมลทำปฏิกิริยากับสาร B หนึ่งโมล สารละลายทั้งสองที่มีความเข้มข้นโมลาร์เท่ากันจะต้องผสมกันเพื่อให้ปฏิกิริยาดำเนินไปอย่างสมบูรณ์ ในกรณีของปฏิกิริยาประเภท A + 2B → C กล่าวคือ สาร A หนึ่งโมลทำปฏิกิริยากับสาร B สองโมล ควรผสมสารละลาย A หนึ่งปริมาตรกับสารละลาย B สองปริมาตร ในกรณีนี้มีสารละลายอื่นด้วย เพราะแทนที่จะใช้ สารละลายเท่ากัน ในอัตราส่วนปริมาตร 1:2 อาจใช้สารละลาย A หนึ่งปริมาตรและสารละลาย B หนึ่งปริมาตรที่มีความเข้มข้นสองเท่า ความเข้มข้นของโมลาร์ แสดงด้วย C m กำหนดจำนวนโมลของสารที่บรรจุในหน่วยปริมาตร ซึ่งส่วนใหญ่มักจะอยู่ใน 1 dm 3 ของสารละลาย สูตรที่ใช้คำนวณความเข้มข้นของโมลาร์คือผลหารของจำนวนโมลของสาร (n s ) และปริมาตรทั้งหมดของสารละลาย (V โซล ) ในหน่วย dm 3 : 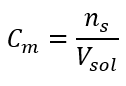 ใช้หน่วยปริมาตรพื้นฐานตามระบบ SI คือ ลูกบาศก์เมตร กิโลโมล ควรใช้เป็นหน่วยของปริมาณสาร อย่างไรก็ตาม นี่ไม่ใช่ปัญหาการคำนวณที่สำคัญเพราะ
ใช้หน่วยปริมาตรพื้นฐานตามระบบ SI คือ ลูกบาศก์เมตร กิโลโมล ควรใช้เป็นหน่วยของปริมาณสาร อย่างไรก็ตาม นี่ไม่ใช่ปัญหาการคำนวณที่สำคัญเพราะ 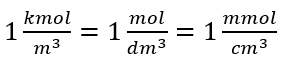 . หน่วยของความเข้มข้นของโมลาร์ C m ถูกกำหนดเป็นโมลต่อลูกบาศก์เดซิเมตร ซึ่งมักเรียกว่า M 1 mol/dm 3 = 1M
. หน่วยของความเข้มข้นของโมลาร์ C m ถูกกำหนดเป็นโมลต่อลูกบาศก์เดซิเมตร ซึ่งมักเรียกว่า M 1 mol/dm 3 = 1M 
การใช้ความเข้มข้นของโมลาร์
ก) การคำนวณความเข้มข้นของโมลาร์ตามเนื้อหาของส่วนประกอบในสารละลาย ตัวอย่างที่ 1 สารละลายประกอบด้วยโพแทสเซียมไฮดรอกไซด์ 30 กรัมในสารละลาย 3.0 dm 3 คำนวณความเข้มข้นของโมลาร์ ขั้นตอนที่ 1 การคำนวณมวลโมลาร์ของ KOH 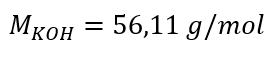 ขั้นตอนที่ 2 การคำนวณจำนวนโมลของ KOH ในสารละลาย
ขั้นตอนที่ 2 การคำนวณจำนวนโมลของ KOH ในสารละลาย 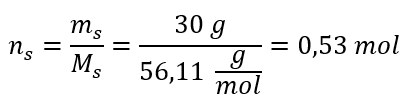 ขั้นตอนที่ 3 การคำนวณความเข้มข้นของโมลาร์โดยใช้สูตร
ขั้นตอนที่ 3 การคำนวณความเข้มข้นของโมลาร์โดยใช้สูตร 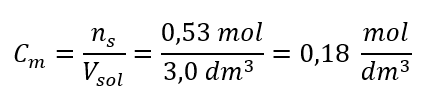 คำตอบ: ความเข้มข้นโมลาร์ของสารละลายโพแทสเซียมไฮดรอกไซด์ที่มีสาร 30 กรัมใน 3.0 dm 3 ของสารละลายคือ C m =
คำตอบ: ความเข้มข้นโมลาร์ของสารละลายโพแทสเซียมไฮดรอกไซด์ที่มีสาร 30 กรัมใน 3.0 dm 3 ของสารละลายคือ C m = 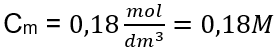 b) การเตรียมสารละลายที่มีความเข้มข้นที่กำหนด ตัวอย่าง 2. คำนวณมวลของกลูโคส (C 6 H 12 O 6 ) ที่จำเป็นสำหรับการเตรียมสารละลาย 300 cm 3 ที่มีความเข้มข้น 0.32 mol/dm 3 . ขั้นตอนที่ 1 การคำนวณมวลโมลาร์ของกลูโคส
b) การเตรียมสารละลายที่มีความเข้มข้นที่กำหนด ตัวอย่าง 2. คำนวณมวลของกลูโคส (C 6 H 12 O 6 ) ที่จำเป็นสำหรับการเตรียมสารละลาย 300 cm 3 ที่มีความเข้มข้น 0.32 mol/dm 3 . ขั้นตอนที่ 1 การคำนวณมวลโมลาร์ของกลูโคส 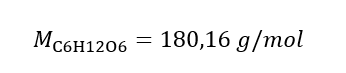 ขั้นตอนที่ 2 การคำนวณมวลของกลูโคสที่ต้องการโดยใช้สูตรโมลาร์ที่แปลงแล้ว
ขั้นตอนที่ 2 การคำนวณมวลของกลูโคสที่ต้องการโดยใช้สูตรโมลาร์ที่แปลงแล้ว 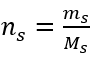 :
: 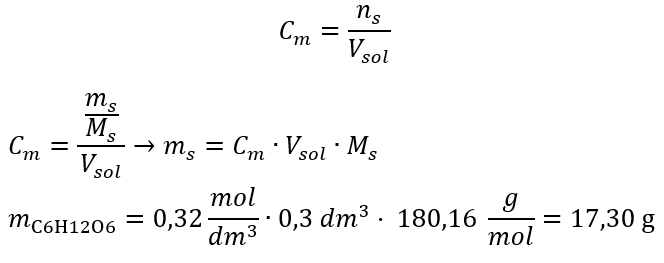 หลังจากการคำนวณเหล่านี้ เราทราบว่าเพื่อเตรียมสารละลายดังกล่าว ควรชั่งน้ำหนักกลูโคส 17.30 กรัมและถ่ายโอนในเชิงปริมาณไปยังขวดวัดปริมาตรขนาด 300 ซม . 3 คำตอบ: ในการเตรียมสารละลายกลูโคส 300 ซม. 3 ที่มีความเข้มข้นโมล 0.32 โมล/เดซิเมตร 3 ควรชั่งสาร 17.30 กรัม c) การเจือจางและความเข้มข้นของสารละลายเข้มข้น การใช้ความเข้มข้นโมลาร์ เรายังสามารถเตรียมสารละลายที่มีความเข้มข้นที่กำหนด (C m2 ) โดยการเจือจางสารละลายเข้มข้น (C m1 ) โดยที่:
หลังจากการคำนวณเหล่านี้ เราทราบว่าเพื่อเตรียมสารละลายดังกล่าว ควรชั่งน้ำหนักกลูโคส 17.30 กรัมและถ่ายโอนในเชิงปริมาณไปยังขวดวัดปริมาตรขนาด 300 ซม . 3 คำตอบ: ในการเตรียมสารละลายกลูโคส 300 ซม. 3 ที่มีความเข้มข้นโมล 0.32 โมล/เดซิเมตร 3 ควรชั่งสาร 17.30 กรัม c) การเจือจางและความเข้มข้นของสารละลายเข้มข้น การใช้ความเข้มข้นโมลาร์ เรายังสามารถเตรียมสารละลายที่มีความเข้มข้นที่กำหนด (C m2 ) โดยการเจือจางสารละลายเข้มข้น (C m1 ) โดยที่: 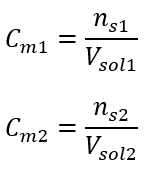 ระหว่างการเจือจาง ปริมาตรของสารละลายจะเปลี่ยนไปเท่านั้น จำนวนโมลของตัวถูกละลายจะไม่เปลี่ยนแปลง ดังนั้นจึงอาจสันนิษฐานได้ว่า:
ระหว่างการเจือจาง ปริมาตรของสารละลายจะเปลี่ยนไปเท่านั้น จำนวนโมลของตัวถูกละลายจะไม่เปลี่ยนแปลง ดังนั้นจึงอาจสันนิษฐานได้ว่า: ![]() โดยการเปลี่ยนสูตรสำหรับความเข้มข้นของโมลาร์ เราได้รับความสัมพันธ์ต่อไปนี้:
โดยการเปลี่ยนสูตรสำหรับความเข้มข้นของโมลาร์ เราได้รับความสัมพันธ์ต่อไปนี้: 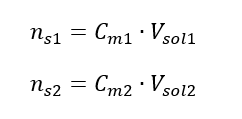 รู้ว่าเราได้สมการ:
รู้ว่าเราได้สมการ: 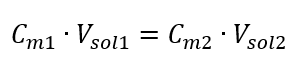 สูตรสำหรับการเจือจางของสารละลาย โดยพิจารณาจากความเข้มข้นของโมลาร์ รวมทั้งค่าที่ได้รับใหม่ (C mx ) สามารถสังเกตได้ดังนี้:
สูตรสำหรับการเจือจางของสารละลาย โดยพิจารณาจากความเข้มข้นของโมลาร์ รวมทั้งค่าที่ได้รับใหม่ (C mx ) สามารถสังเกตได้ดังนี้: 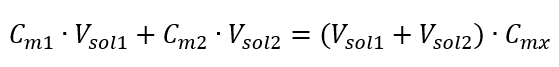 ตัวอย่างที่ 3 ปริมาตรของกรด 0.150 โมล/เดซิเมตร 3 สามารถหาได้โดยการเจือจาง 250 ซม. 3 ของสารละลาย 0.750 โมล/ เดซิเมตร ของกรดนี้กับน้ำ ขั้นตอนที่ 1 การแปลงสูตรโดยตั้งสมมติฐานว่าความเข้มข้นของน้ำคือ C m2 = 0 mol/dm 3
ตัวอย่างที่ 3 ปริมาตรของกรด 0.150 โมล/เดซิเมตร 3 สามารถหาได้โดยการเจือจาง 250 ซม. 3 ของสารละลาย 0.750 โมล/ เดซิเมตร ของกรดนี้กับน้ำ ขั้นตอนที่ 1 การแปลงสูตรโดยตั้งสมมติฐานว่าความเข้มข้นของน้ำคือ C m2 = 0 mol/dm 3 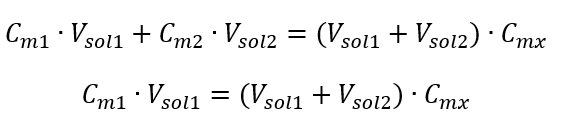 ขั้นตอนที่ 2 การคำนวณปริมาตรรวม (V x )
ขั้นตอนที่ 2 การคำนวณปริมาตรรวม (V x ) 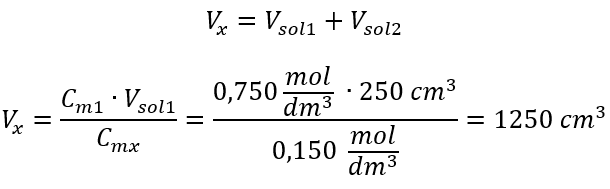 อีกวิธีหนึ่งคือสามารถใช้ความสัมพันธ์ของความคงทนของจำนวนโมลระหว่างการเจือจางได้:
อีกวิธีหนึ่งคือสามารถใช้ความสัมพันธ์ของความคงทนของจำนวนโมลระหว่างการเจือจางได้: 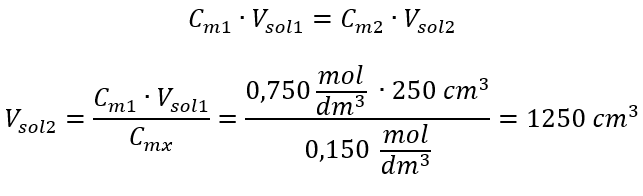 คำตอบ: ในการเจือจางกรดให้ได้ความเข้มข้นที่ต้องการ ต้องใช้น้ำ 1.25 dm 3 ตัวอย่างที่ 4 คำนวณปริมาณน้ำที่ต้อง ระเหยออกจากสารละลาย 300 ซม. ที่มีความเข้มข้น 0.125 โมล/เดซิเมตร 3 เพื่อ ให้ได้สารละลายที่มีความเข้มข้น 1.50 โมล/เดซิเมตร 3 ขั้นตอนที่ 1 การแปลงสูตรสำหรับการเปลี่ยนแปลงความเข้มข้นของโมลโดยมีสมมติฐานว่าความเข้มข้นของโมลาร์ของน้ำคือ C m2 = 0 โมล/dm 3
คำตอบ: ในการเจือจางกรดให้ได้ความเข้มข้นที่ต้องการ ต้องใช้น้ำ 1.25 dm 3 ตัวอย่างที่ 4 คำนวณปริมาณน้ำที่ต้อง ระเหยออกจากสารละลาย 300 ซม. ที่มีความเข้มข้น 0.125 โมล/เดซิเมตร 3 เพื่อ ให้ได้สารละลายที่มีความเข้มข้น 1.50 โมล/เดซิเมตร 3 ขั้นตอนที่ 1 การแปลงสูตรสำหรับการเปลี่ยนแปลงความเข้มข้นของโมลโดยมีสมมติฐานว่าความเข้มข้นของโมลาร์ของน้ำคือ C m2 = 0 โมล/dm 3 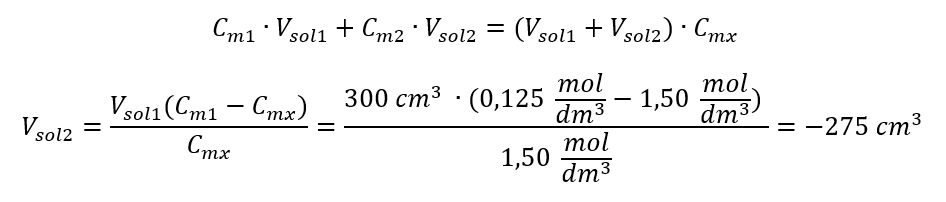 คำตอบ: เพื่อให้สารละลายเข้มข้น 275 จะต้องระเหย การแปลงความเข้มข้นของโมลาร์เทียบกับความเข้มข้นร้อยละ ในการทำงานในห้องปฏิบัติการทุกวัน จำเป็นต้องแปลงสารละลายที่มีความเข้มข้นต่างกัน ส่วนใหญ่มักใช้ความเข้มข้นของโมลาร์และความเข้มข้นของเปอร์เซ็นต์ สามารถสลับระหว่างกันได้โดยใช้ความหนาแน่นของสารละลาย ต้องนำพารามิเตอร์นี้ไปใช้กับสูตรสำหรับความเข้มข้นที่น่าสนใจ:
คำตอบ: เพื่อให้สารละลายเข้มข้น 275 จะต้องระเหย การแปลงความเข้มข้นของโมลาร์เทียบกับความเข้มข้นร้อยละ ในการทำงานในห้องปฏิบัติการทุกวัน จำเป็นต้องแปลงสารละลายที่มีความเข้มข้นต่างกัน ส่วนใหญ่มักใช้ความเข้มข้นของโมลาร์และความเข้มข้นของเปอร์เซ็นต์ สามารถสลับระหว่างกันได้โดยใช้ความหนาแน่นของสารละลาย ต้องนำพารามิเตอร์นี้ไปใช้กับสูตรสำหรับความเข้มข้นที่น่าสนใจ: 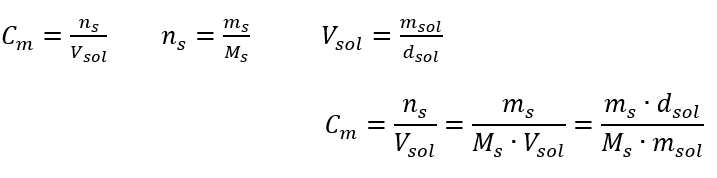 ในการแปลง เราสามารถเห็นอัตราส่วนของมวลสารต่อมวลของสารละลาย ซึ่งเป็นพื้นฐานของความเข้มข้นร้อยละที่แสดงโดยสูตร:
ในการแปลง เราสามารถเห็นอัตราส่วนของมวลสารต่อมวลของสารละลาย ซึ่งเป็นพื้นฐานของความเข้มข้นร้อยละที่แสดงโดยสูตร: 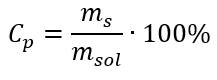 แทนที่สูตรสำหรับความเข้มข้นของเปอร์เซ็นต์ลงในสูตรที่แปลงก่อนหน้านี้สำหรับความเข้มข้นของโมลาร์ เราได้รับความสัมพันธ์ที่ช่วยให้เราสามารถสลับระหว่างค่าทั้งสองได้อย่างอิสระ:
แทนที่สูตรสำหรับความเข้มข้นของเปอร์เซ็นต์ลงในสูตรที่แปลงก่อนหน้านี้สำหรับความเข้มข้นของโมลาร์ เราได้รับความสัมพันธ์ที่ช่วยให้เราสามารถสลับระหว่างค่าทั้งสองได้อย่างอิสระ: 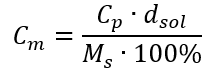 ข้อ จำกัด เพียงอย่างเดียวของสูตรคือการใช้หน่วยที่เหมาะสม ดังนั้นจึงควรพิจารณาหน่วยเหล่านี้ในการคำนวณทั้งหมด ตัวอย่างที่ 5 คำนวณความเข้มข้นโมลาร์ของกรดกำมะถัน (VI) โดยรู้ว่าความเข้มข้นเป็นเปอร์เซ็นต์คือ C p = 98.0%และความหนาแน่นของกรดคือ d = 1.84 กก./ลบ.ม. 3 สามารถคำนวณได้สองวิธี: วิธีที่ 1 ในไม่กี่ขั้นตอนโดยไม่ต้องใช้สูตร ขั้นตอนที่ 1 การคำนวณมวล 1.00 dm 3 ของกรด
ข้อ จำกัด เพียงอย่างเดียวของสูตรคือการใช้หน่วยที่เหมาะสม ดังนั้นจึงควรพิจารณาหน่วยเหล่านี้ในการคำนวณทั้งหมด ตัวอย่างที่ 5 คำนวณความเข้มข้นโมลาร์ของกรดกำมะถัน (VI) โดยรู้ว่าความเข้มข้นเป็นเปอร์เซ็นต์คือ C p = 98.0%และความหนาแน่นของกรดคือ d = 1.84 กก./ลบ.ม. 3 สามารถคำนวณได้สองวิธี: วิธีที่ 1 ในไม่กี่ขั้นตอนโดยไม่ต้องใช้สูตร ขั้นตอนที่ 1 การคำนวณมวล 1.00 dm 3 ของกรด 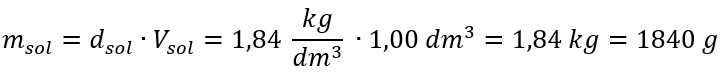 ขั้นตอนที่ 2 การคำนวณมวลของกรดโดยคำนึงถึงความเข้มข้นร้อยละ
ขั้นตอนที่ 2 การคำนวณมวลของกรดโดยคำนึงถึงความเข้มข้นร้อยละ 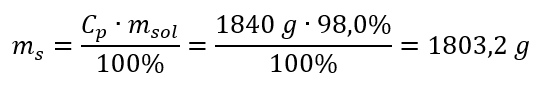 ขั้นตอนที่ 3 การคำนวณจำนวนโมล
ขั้นตอนที่ 3 การคำนวณจำนวนโมล 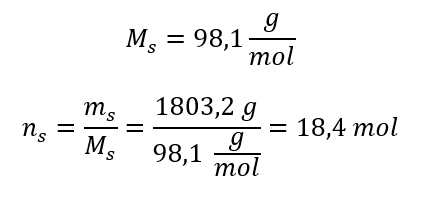 ขั้นตอนที่ 4 การคำนวณหาความเข้มข้นของโมลาร์ โดยทราบว่าเป็นจำนวนโมลของสารใน 1 dm 3 ของสารละลาย
ขั้นตอนที่ 4 การคำนวณหาความเข้มข้นของโมลาร์ โดยทราบว่าเป็นจำนวนโมลของสารใน 1 dm 3 ของสารละลาย 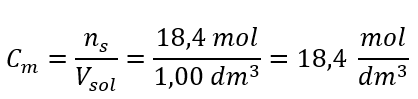 วิธีที่ 2 ใช้ความสัมพันธ์ระหว่างความเข้มข้นร้อยละและความเข้มข้นของโมลาร์
วิธีที่ 2 ใช้ความสัมพันธ์ระหว่างความเข้มข้นร้อยละและความเข้มข้นของโมลาร์ 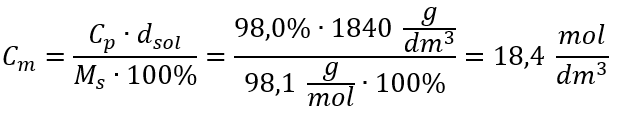 คำตอบ: ความเข้มข้นของโมลาร์ของกรดนี้คือ 18.4 โมล/เดซิเมตร 3
คำตอบ: ความเข้มข้นของโมลาร์ของกรดนี้คือ 18.4 โมล/เดซิเมตร 3
