ในกรณีของปฏิกิริยาเคมี การเปลี่ยนสารตั้งต้นเป็นผลิตภัณฑ์โดยสมบูรณ์นั้นสังเกตได้จากส่วนเล็กๆ เท่านั้น ส่วนใหญ่รวมทั้งที่เกิดขึ้นในร่างกายของเราจะย้อนกลับได้ สำหรับกระบวนการดังกล่าวจะมีการสร้างสภาวะสมดุลทางเคมี นี่เป็นแนวคิดที่สำคัญอย่างยิ่งในวิชาเคมี ซึ่งเกี่ยวข้องกับหลักการของ Le Chatelier (หรือกฎสมดุล) ตัวอย่างเช่น ความรู้เกี่ยวกับกฎพื้นฐานและหลักการเกี่ยวกับสมดุลเคมีช่วยให้สามารถทำนายปฏิกิริยาต่างๆ หรือดำเนินกระบวนการทางเทคโนโลยีได้อย่างมีประสิทธิภาพมากขึ้น
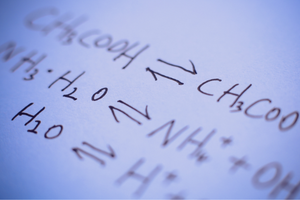
ปฏิกิริยาย้อนกลับและย้อนกลับไม่ได้
เมื่อพิจารณาถึงปฏิกิริยาเคมีแล้ว การแบ่งทั่วไปสามารถแบ่งออกเป็นปฏิกิริยาที่ผันกลับได้และย้อนกลับไม่ได้ อย่างไรก็ตาม ควรจำไว้ว่าในความเป็นจริงไม่มีปฏิกิริยาใดที่ย้อนกลับไม่ได้ 100%และคุณสมบัติของกลุ่มใดกลุ่มหนึ่งจะขึ้นอยู่กับผลสุดท้ายที่เกิดขึ้น
ปฏิกิริยาที่ผันกลับไม่ได้
ในกรณีนี้ วัสดุพิมพ์ในระบบจะทำปฏิกิริยาและส่งผลให้เกิดผลิตภัณฑ์เฉพาะ อย่างไรก็ตาม ไม่มีการเปลี่ยนแปลงย้อนกลับ – ผลิตภัณฑ์เป็นสารตั้งต้น ในสูตร ลูกศรหนึ่งลูกศรถูกทำเครื่องหมายระหว่างสารตั้งต้น และลูกศรชี้ไปที่ผลิตภัณฑ์ ปฏิกิริยาที่ผันกลับไม่ได้โดยหลักแล้วคือปฏิกิริยาทั้งหมดที่ก่อให้เกิดการตกตะกอน ในทางปฏิบัติจะไม่ละลายในน้ำและไม่สามารถสร้างขึ้นใหม่ได้ การย้อนกลับของกระบวนการยังทำได้ยากในกรณีของปฏิกิริยาที่เกิดขึ้นในระบบเปิด เช่น ในบีกเกอร์หรือขวดทรงกลม ซึ่งหนึ่งในผลิตภัณฑ์ที่เป็นผลลัพธ์ เช่น ก๊าซคาร์บอนไดออกไซด์ สามารถหลบหนีได้อย่างอิสระ แต่ด้วยการเปลี่ยนแปลงเงื่อนไข ของปฏิกิริยา กล่าวคือโดยการถ่ายโอนไปยังระบบปิด มันสามารถย้อนกลับได้ กลุ่มของปฏิกิริยาที่ผันกลับไม่ได้ยังรวมถึงกระบวนการทั้งหมดที่ปฏิสัมพันธ์ระหว่างโมเลกุลของผลิตภัณฑ์เกิดขึ้นในระดับที่น้อยกว่าระหว่างสารตั้งต้น ดังนั้นกระบวนการดังกล่าวจึงเกิดขึ้นในทั้งสองทิศทาง แต่เนื่องจากการสร้างใหม่ของสารตั้งต้นนั้นไม่สำคัญนัก ในทางปฏิบัติพวกมันจึงถูกจัดประเภทเป็นปฏิกิริยาที่ย้อนกลับไม่ได้
ปฏิกิริยาย้อนกลับ
ปฏิกิริยาเหล่านี้เป็นปฏิกิริยาที่ผลิตภัณฑ์ก่อตัวขึ้นจากสารตั้งต้น และในขณะเดียวกัน กระบวนการย้อนกลับจะเกิดขึ้นด้วยความเข้มข้นที่ใกล้เคียงกัน นั่นคือการสร้างสารตั้งต้นขึ้นใหม่จากผลิตภัณฑ์ ในสูตรปฏิกิริยา ลูกศรสองลูกถูกวางไว้ระหว่างสารตั้งต้น โดยลูกศรชี้ไปในทิศทางตรงกันข้าม เพื่อระบุความสามารถในการย้อนกลับของปฏิกิริยาที่เกิดขึ้น ปฏิกิริยาที่ผันกลับได้ส่วนใหญ่เป็นปฏิกิริยาที่เกิดขึ้นในระบบปิด โมเลกุลของสารตั้งต้นและผลิตภัณฑ์ไม่สามารถออกจากสภาพแวดล้อมที่เกิดปฏิกิริยาได้ และพวกมันจะชนกันเอง ทำให้เกิดผลิตภัณฑ์และสร้างสารตั้งต้นขึ้นใหม่ ตัวอย่างของปฏิกิริยาดังกล่าวคือการผลิตไฮโดรเจนไอโอไดด์จากไอโอดีนและไฮโดรเจน
สภาวะสมดุลทางเคมี
ปฏิกิริยาเฉพาะสามารถเกิดขึ้นได้ หรือหากย้อนกลับได้หรือย้อนกลับไม่ได้ ขึ้นอยู่กับเงื่อนไขของกระบวนการเฉพาะและประเภทของกระบวนการเป็นสำคัญ หากเกิดปฏิกิริยาย้อนกลับได้ เช่น สารตั้งต้นเปลี่ยนเป็นผลิตภัณฑ์อันเป็นผลมาจากปฏิกิริยาเคมี และในขณะเดียวกัน อันเป็นผลมาจากการชนกันของโมเลกุลของผลิตภัณฑ์ สารตั้งต้นจะเกิดการปะทุขึ้น จากนั้นเมื่อเกิดปฏิกิริยาเหล่านี้ขึ้น ณ จุดใดจุดหนึ่ง มีการสร้างสภาวะสมดุลทางเคมี กล่าวอีกนัยหนึ่งคือ ความเข้มข้นของสารตั้งต้นและผลิตภัณฑ์ในระบบอยู่ในระดับคงที่ – ปริมาณของสารตั้งต้นและผลิตภัณฑ์จะไม่เปลี่ยนแปลงแม้ว่าจะมีปฏิกิริยาต่อเนื่องก็ตาม ในสภาวะสมดุลเคมี อัตราการเกิดปฏิกิริยาทั้งสองทิศทางจะเท่ากัน สภาวะสมดุลทางเคมี ภายใต้เงื่อนไขบางประการ หมายถึงสภาวะที่เสถียรที่สุดสำหรับระบบใดระบบหนึ่ง ความต้องการพลังงานจึงต่ำมาก ค่าคงที่สมดุลเคมี K เป็นค่าสัมประสิทธิ์ที่อธิบายสมดุลของปฏิกิริยาที่ผันกลับได้สองปฏิกิริยา ซึ่งถูกกำหนดให้เป็นผลหารของความเข้มข้นของผลิตภัณฑ์และสารตั้งต้นที่ยกกำลังขึ้นตามค่าสัมประสิทธิ์ปริมาณสารสัมพันธ์ที่วัดได้ในสภาวะสมดุลทางเคมี สูตรสำหรับค่าคงที่ได้รับมาในปี พ.ศ. 2407 โดยเรียกว่ากฎของการกระทำโดยมวล ควรจำไว้ว่านี่เป็นค่าลักษณะเฉพาะสำหรับปฏิกิริยาเฉพาะ มีหลายปัจจัยที่ส่งผลต่อสภาวะสมดุลทางเคมี นี่คือบางส่วนของพวกเขา:
- อุณหภูมิ,
- ปริมาตรของระบบปฏิกิริยา
- ความดัน,
- ความเข้มข้นของสารตั้งต้น
สิ่งสำคัญคือ ตำแหน่งของสภาวะสมดุลจะไม่ได้รับผลกระทบจากการเพิ่มหรือเปลี่ยนตัวเร่งปฏิกิริยา หน้าที่ของมันคือลดระยะเวลาที่เข้าสู่สมดุลเท่านั้น 
หลักการของ Le Chatelier (กฎแห่งดุลยภาพ)
โดยการเปลี่ยนสภาวะปฏิกิริยาบางอย่าง เราสามารถมีอิทธิพลต่อสภาวะสมดุลของมันได้ ระบบจะพยายามรักษาสมดุลเสมอ เพราะเป็นระบบที่เอื้อต่อพลังงาน (ใช้พลังงานต่ำที่สุด) ผลที่ตามมาคือจะมีการเปลี่ยนแปลงที่ขัดขวางปัจจัยต่างๆ ที่ทำให้ระบบไม่สมดุล ปรากฏการณ์นี้ได้รับการอธิบายในปี พ.ศ. 2424 และเป็นที่รู้จักกันในปัจจุบันว่าเป็นหลักการของ Le Chatelier-Braun หรือกฎแห่งดุลยภาพ ช่วยให้เข้าใจการตอบสนองของระบบต่อการเปลี่ยนแปลงสภาวะของปฏิกิริยาซึ่งอยู่ในสภาวะสมดุลทางเคมี การเพิ่มหนึ่งในสารทำปฏิกิริยาในระบบทำให้เกิดการรบกวนสมดุล ความเข้มข้นของสารตั้งต้นแต่ละตัวเปลี่ยนไป ดังนั้น เพื่อแก้ปัญหานี้ ระบบมีแนวโน้มที่จะผลิตผลิตภัณฑ์มากขึ้น (เมื่อมีการเพิ่มวัสดุพิมพ์) หรือสร้างวัสดุพิมพ์ขึ้นใหม่ (เมื่อมีการเพิ่มผลิตภัณฑ์จำนวนหนึ่ง) การเปลี่ยนแปลงอุณหภูมิของปฏิกิริยามีผลกระทบอย่างมาก โดยเฉพาะอย่างยิ่งสำหรับกระบวนการดูดความร้อนและคายความร้อน ในกรณีของอดีต จำเป็นต้องจ่ายพลังงานให้กับระบบในรูปของความร้อน ดังนั้น การเพิ่มอุณหภูมิของกระบวนการทั้งหมดจะเลื่อนสมดุลไปทางขวา (ลดลงไปทางซ้าย) ไปสู่การก่อตัวของผลิตภัณฑ์มากขึ้น . ตรงกันข้ามจะเป็นกรณีของปฏิกิริยาคายความร้อนซึ่งหนึ่งในผลิตภัณฑ์คือความร้อน อุณหภูมิไม่มีผลต่อสมดุลของปฏิกิริยา โดยที่ไม่มีผลกระทบต่อความร้อน ในกรณีของปฏิกิริยาที่เกิดขึ้นในเฟสของก๊าซ ความดันเป็นสิ่งสำคัญมาก การเพิ่มค่าของพารามิเตอร์นี้ เช่น การลดปริมาณปฏิกิริยาของระบบ จะทำให้สมดุลของปฏิกิริยาเปลี่ยนไป ทิศทางของการเปลี่ยนแปลงขึ้นอยู่กับค่าสัมประสิทธิ์ปริมาณสัมพันธ์ในสมการปฏิกิริยา พารามิเตอร์นี้จะไม่ส่งผลต่อสมดุลทางเคมีของปฏิกิริยา ซึ่งผลรวมของค่าสัมประสิทธิ์ปริมาณสารสัมพันธ์ของสารตั้งต้นที่เป็นก๊าซและผลิตภัณฑ์จะเท่ากัน เป็นสิ่งที่ควรค่าแก่การจดจำว่าเมื่อระบบหลุดออกจากสมดุลเคมี กฎแห่งสมดุลจะถูกนำมาใช้ และเป็นผลให้เข้าสู่สภาวะสมดุลใหม่

