นี่คือกลุ่มของสารประกอบอนินทรีย์ที่เกิดจากการรวมตัวของธาตุต่างๆ กับออกซิเจน สูตรทั่วไปคือ X n O m โดยที่ "X" คือธาตุใดๆ "O" คือออกซิเจน อยู่ในสถานะออกซิเดชันที่สองเสมอ และตัวอักษร "n,m" ในดัชนีล่างคือค่าสัมประสิทธิ์ ตัวอย่างของออกไซด์: น้ำ H 2 O โพแทสเซียมออกไซด์ K 2 O อลูมิเนียมออกไซด์ Al 2 O 3 แคลเซียมออกไซด์ CaO และคาร์บอน (II) มอนอกไซด์ CO

การจำแนกประเภทของออกไซด์
ออกไซด์สามารถแบ่งออกได้เป็นหลายประเภท การจำแนกประเภททั่วไปที่สุดคือความแตกต่างระหว่างออกไซด์ของโลหะ เช่น ลิเธียมออกไซด์ แมกนีเซียมออกไซด์ อะลูมิเนียมออกไซด์ เหล็กออกไซด์ และออกไซด์ที่ไม่ใช่โลหะ ซึ่งรวมถึงคาร์บอนออกไซด์ ไนโตรเจนออกไซด์ ซัลเฟอร์ออกไซด์ และ คลอรีน ออกไซด์ อีกเกณฑ์หนึ่งคือ การจำแนกตามสภาพร่างกาย ออกไซด์ของโลหะเกือบทั้งหมดและอโลหะบางชนิด (SiO 2 , P 4 O 10 ) เป็นของแข็ง น้ำ ซัลเฟอร์ (VI) ออกไซด์ และแมงกานีส (VII) ออกไซด์เป็นของเหลว ออกไซด์ของอโลหะ เช่น CO, CO 2 , SO 2 , NO i NO 2 เป็นก๊าซ ออกไซด์สามารถจำแนกตามประเภทของพันธะที่เกิดขึ้นได้ แมกนีเซียมออกไซด์ MgO แคลเซียมออกไซด์ CaO หรือโซเดียมออกไซด์ Na 2 O มี O 2- ไอออนและพันธะไอออนิก ดังนั้นชื่อของมัน – ไอออนิกออกไซด์ อีกกลุ่มหนึ่งคือออกไซด์ของโควาเลนต์ เช่น คาร์บอน (II) มอนอกไซด์ CO, ไนตริก (II) ออกไซด์ NO หรือซัลเฟอร์ (IV) ออกไซด์ SO 2 ซึ่งพันธะระหว่างอะตอมของออกซิเจนกับธาตุมีรูปแบบเป็นพันธะโควาเลนต์ที่มีขั้ว
ลักษณะทางเคมีของออกไซด์
สำหรับนักเคมี การจำแนกประเภทที่น่าสนใจที่สุดนั้นขึ้นอยู่กับลักษณะทางเคมีของออกไซด์ ออกไซด์มีสี่ประเภทหลัก ได้แก่ กรด ด่าง เป็นกลาง และแอมโฟเทอริก
- ออกไซด์ที่เป็นกรด บางครั้งเรียกอีกอย่างว่าแอซิดแอนไฮไดรด์ แตกต่างจากความจริงที่ว่าพวกมัน ทำปฏิกิริยากับด่างด้วยการก่อตัวของเกลือ ส่วนสำคัญของออกไซด์ที่เป็นกรดก่อให้เกิดสารละลายที่เหมาะสมของ ออกซิแอซิด หลังจากละลายในน้ำ สิ่งนี้ใช้กับ เช่น ซัลเฟอร์ (IV) ออกไซด์ซึ่งเมื่อละลายในน้ำจะทำให้เกิด กรดซัลฟิวริก (IV) และกับโครเมียม (VI) ออกไซด์ซึ่งละลายเป็นกรดโครมิก (VI)
SO 2 + H 2 O → H 2 SO 3 CrO 3 + H 2 O → H 2 CrO 4 มีออกไซด์ที่เป็นกรดกลุ่มเล็กๆ ที่ไม่ละลายในน้ำ อย่างไรก็ตาม พวกมันสามารถละลายได้ในสารละลายของด่างแก่ เช่น ซิลิกอน ( IV) ออกไซด์ SiO 2 , โมลิบดีนัม (VI) ออกไซด์ MoO 3 , และทังสเตน (VI) ออกไซด์ WO 3 . ปฏิกิริยากับด่างยืนยันลักษณะที่เป็นกรด: SiO 2 + 2NaOH → Na 2 SiO 3 + H 2 O MoO 3 + 2KOH → K 2 MoO 4 + H 2 O WO 3 + 2NaOH → Na 2 WO 4 + H 2 O As a ตามกฎแล้ว ออกไซด์ที่เป็นกรดคือออกไซด์ที่ไม่ใช่โลหะและออกไซด์ของโลหะที่สถานะออกซิเดชันสูงสุดที่เป็นไปได้ ถ้าองค์ประกอบหนึ่งๆ ก่อให้เกิดออกไซด์หลายสถานะที่สถานะออกซิเดชันต่างๆ เช่น โครเมียม คุณสมบัติที่เป็นกรดของออกไซด์ของธาตุนั้นจะเพิ่มขึ้นตามการเพิ่มขึ้นของสถานะออกซิเดชัน:
- โครเมียม (II) CrO ออกไซด์เป็นด่าง
- โครเมียม (III) ออกไซด์ Cr 2 O 3 มีคุณสมบัติแอมโฟเทอริก
- โครเมียม (VI) ออกไซด์ CrO 3 มีสภาพเป็นกรด

- ออกไซด์ของอัลคาลิก เป็นสารประกอบของออกซิเจนกับโลหะที่ ทำปฏิกิริยากับกรดเพื่อให้ได้ผลิตภัณฑ์ในรูปของเกลือที่สอดคล้องกัน บางส่วน ได้แก่ ออกไซด์ของธาตุจากกลุ่มที่หนึ่งและสองของตารางธาตุ ยกเว้นเบริลเลียม มีลักษณะเฉพาะด้วยปฏิกิริยากับน้ำซึ่งทำให้เกิดอัลคาลิกไฮดรอกไซด์ เกิดขึ้น เช่น ระหว่างปฏิกิริยาของโซเดียมออกไซด์ ลิเธียมออกไซด์ และแบเรียมออกไซด์กับน้ำ:
Na 2 O + H 2 O → 2NaOH Li 2 O + H 2 O → 2LiOH BaO + H 2 O → Ba(OH) 2 นอกจากนี้ยังมีอัลคาลิกออกไซด์ที่ไม่ละลายในน้ำ แต่จะละลายในสารละลายกรดเท่านั้น เหล่านี้รวมถึง เช่น แมงกานีส (II) ออกไซด์และเหล็ก (II) ออกไซด์: MnO + H 2 SO 4 → MnSO 4 + H 2 O FeO + 2HCl → FeCl 2 + H 2 O
- ออกไซด์ที่เป็นกลาง เป็นกลุ่มออกไซด์ที่มีปฏิกิริยาน้อยที่สุด พวกเขาไม่ทำปฏิกิริยากับกรดหรือด่าง พวกเขายังไม่ละลายในน้ำ ตัวอย่างของออกไซด์กลุ่มนี้ ได้แก่ คาร์บอน (II) มอนอกไซด์ CO และไนตริก (II) ออกไซด์ NO
- แอมโฟเทอริกออกไซด์ เป็นสิ่งที่ตรงกันข้ามกับออกไซด์ที่เป็นกลางและมีทั้งกรดและด่างในเวลาเดียวกัน ซึ่งหมายความว่าพวกมัน ทำปฏิกิริยากับทั้งด่างและกรดแก่ ผลิตภัณฑ์ของปฏิกิริยาเหล่านี้มักจะเป็นเกลือ และองค์ประกอบที่รวมกับออกซิเจนในขั้นต้นจะเปลี่ยนเป็นไอออนบวกหรือไอออนบวกที่เหมาะสมของกรดที่เหลือ ความคล้ายคลึงกันเพียงอย่างเดียวกับออกไซด์ที่เป็นกลางคือการละลายในน้ำได้ไม่ดี ตัวอย่างของแอมโฟเทอริกออกไซด์ได้แก่: เบริลเลียมออกไซด์ BeO, อะลูมิเนียมออกไซด์ Al 2 O 3 , โครเมียม (III) ออกไซด์, ดีบุก (II) ออกไซด์ SnO, ตะกั่ว (II) ออกไซด์ PbO และซิงค์ออกไซด์ ZnO โดยการทำปฏิกิริยากับสารละลายที่เป็นน้ำของด่างแก่ เช่น กับสารละลายที่เป็นน้ำของ โซเดียมไฮดรอกไซด์ พวกมันจะกลายเป็น เกลือเชิงซ้อน ในกรดตกค้าง อะตอมหรือไอออนของโลหะซึ่งได้มาจากออกไซด์นั้นอยู่ในสารเชิงซ้อนที่มีจำนวนหมู่ไฮดรอกซิลที่เหมาะสม จำนวนของพวกเขาขึ้นอยู่กับ หมายเลขการประสานงานขององค์ประกอบที่กำหนด ตัวอย่างเช่น อะตอมที่ได้จากออกไซด์ของ MO (M – โลหะ) เช่น เบริลเลียมออกไซด์ BeO มีหมายเลขโคออร์ดิเนชันเป็น 4 อะตอมที่มาจากออกไซด์ประเภท M 2 O 3 เช่น Al 2 O 3 สามารถมีหมายเลขโคออร์ดิเนชันต่างกันได้สองหมายเลข และ ขึ้นอยู่กับเงื่อนไขของปฏิกิริยาคือ 4 หรือ 6 ตัวอย่างปฏิกิริยาของแอมโฟเทอริกออกไซด์:
BeO + 2HCl → BeCl 2 + H 2 O BeO + 2NaOH + H 2 O → Na 2 [Be (OH) 4] โซเดียมเตตระไฮดรอกซีซิลิเนต Al 2 O 3 + 6HCl → 2AlCl 3 + 3H 2 O Al 2 O 3 + 2KOH + 3H 2 O → 2K[Al (OH) 4] โพแทสเซียมเตตระไฮดรอกซีอะลูมิเนต Al 2 O 3 + 6NaOH + 3H 2 O → 2Na 3 [Al (OH) 6] โซเดียมเฮกซะไฮดรอกซีอะลูมิเนต ออกไซด์บางชนิด เช่น ซิงค์ออกไซด์และแมงกานีส (IV) ออกไซด์ มีคุณสมบัติแอมโฟเทอริกค่อนข้างเฉพาะเจาะจง หลังไม่ว่าภายใต้สภาวะปกติหรือมาตรฐานจะไม่ทำปฏิกิริยากับด่าง ในทางกลับกัน ทั้งสองทำปฏิกิริยากับพวกมันโดยการหลอมรวมกับด่างที่เป็นของแข็ง เช่น: 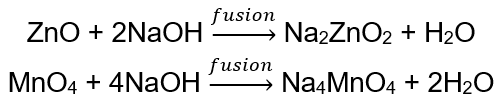

การได้รับออกไซด์
- การสังเคราะห์องค์ประกอบโดยตรง: a) การสังเคราะห์อะตอมของกำมะถันและอะตอมของออกซิเจนด้วยการก่อตัวของกำมะถัน (IV) ออกไซด์ S + O → SO 2 b) การสังเคราะห์อะตอมของแมกนีเซียมและอะตอมของออกซิเจนด้วยการก่อตัวของแมกนีเซียมออกไซด์ 2Mg + O 2 → 2MgO c) การสังเคราะห์อะตอมของคาร์บอนและอะตอมของออกซิเจนด้วยการก่อตัวของคาร์บอน (IV) มอนอกไซด์ C + O 2 → CO 2
- การสลายตัวด้วยความร้อนของ เกลือ ไฮด รอกไซด์ และออกไซด์: ก) การสลายตัวของ แคลเซียมคาร์บอเนต เป็นแคลเซียมออกไซด์และคาร์บอน (IV) มอนอกไซด์ CaCO 3 → CaO + CO 2 ข) การสลายตัวของทองแดง (II) ไฮดรอกไซด์เป็นทองแดง (II) ออกไซด์และน้ำ Cu( OH) 2 → CuO + H 2 O c) การสลายตัวของแมงกานีส (IV) ออกไซด์เป็นแมงกานีส (III) ออกไซด์และออกซิเจน 4MnO 2 → 2Mn 2 O 3 + O 2
- การเกิดออกซิเดชันของออกไซด์ที่สถานะออกซิเดชันที่ต่ำกว่า โดยมีความจุเพิ่มขึ้น: a) ออกซิเดชันของซัลเฟอร์ (IV) ออกไซด์เป็นซัลเฟอร์ (VI) ออกไซด์ 2SO 2 + O 2 → 2SO 3 b) ออกซิเดชันของไนตริก (II) ออกไซด์เป็นไนตริก ( IV) ออกไซด์ 2NO + O 2 → 2NO 2 c) ปฏิกิริยาออกซิเดชันของคาร์บอน (II) มอนอกไซด์เป็นคาร์บอน (IV) มอนอกไซด์ (IV) 2CO + O 2 → 2CO 2
- การลดลงของออกไซด์ที่สถานะออกซิเดชันที่สูงขึ้นโดยมีค่าลดลง: a) การลดลงของคาร์บอน (IV) มอนอกไซด์เป็นคาร์บอน (II) มอนอกไซด์ (II) CO 2 + C → 2CO b) การลดลงของดีบุก (II) ออกไซด์เป็นดีบุก (I) ออกไซด์ 2SnO + O 2 → 2SnO 2
- การเผาไหม้ของสารประกอบอินทรีย์ ก) การเผาไหม้ของมีเทนในออกซิเจนด้วยการก่อตัวของคาร์บอน (IV) มอนอกไซด์และน้ำ CH 4 + 2O 2 → CO 2 + 2H 2 O ข) การเผาไหม้ของแอมโมเนียในออกซิเจนเพื่อให้ได้ไนตริก (II) ออกไซด์และ น้ำ 4NH 3 + 5O 2 → 4NO + 6H 2 O
- ปฏิกิริยาของออกซิแอซิดที่ไม่เสถียร: a) การสลายตัวของ กรดคาร์บอนิก (IV) เป็นคาร์บอน (IV) มอนอกไซด์และน้ำ: H 2 CO 3 → CO 2 + H 2 O b) การสลายตัวของกรดซัลฟิวริก (IV) เป็นซัลเฟอร์ (IV) ออกไซด์ และ น้ำ: H 2 SO 3 → SO 2 + H 2 O
