ในบรรดาสารประกอบอินทรีย์เคมีที่จัดว่าเป็นไฮโดรคาร์บอนไม่อิ่มตัว เราสามารถแยกแยะกลุ่มที่เรียกว่าอัลไคน์ได้ พวกมันอยู่ในกลุ่มของสารประกอบนี้เนื่องจากโครงสร้างของพวกมัน - โมเลกุลประกอบด้วยอะตอมของคาร์บอนและไฮโดรเจนเท่านั้น และหนึ่งในพันธะระหว่างอะตอมของคาร์บอนนั้นไม่อิ่มตัว สำหรับอัลไคน์ นี่คือพันธะสาม C≡C ตัวแทนจำนวนมากของกลุ่มสามารถพบได้ในผลิตภัณฑ์ในชีวิตประจำวัน เช่น น้ำมัน หมึกพิมพ์ และยาฆ่าแมลง แต่ยังมีในเครื่องสำอางซึ่งมีบทบาทในการต้านอนุมูลอิสระ

โครงสร้างของอัลคีน
สูตรทั่วไปสำหรับอัลไคน์คือ C n H 2n-2 และแต่ละชนิดมีพันธะสามอย่างน้อยหนึ่งพันธะ โครงสร้าง พวกมันเป็นไอโซเมอร์ของไดอีน ไซโคลแอลคีน และไซโคลแอลคีนสองวงแหวน แอลไคน์ เช่น แอลเคน หรือ แอลคีน มีโครงสร้างแบบโซ่ตรงหรือกิ่งก้าน นอกเหนือจากพันธะสามซึ่งเป็นพันธะโควาเลนต์แล้ว ยังมีพันธะ CC เดี่ยวแต่ยังมีพันธะโควาเลนต์ระหว่างอะตอมของคาร์บอนและพันธะ CH ระหว่างอะตอมของคาร์บอนและไฮโดรเจนอีกด้วย พันธะสามจะเกิดขึ้นก็ต่อเมื่ออะตอมของคาร์บอน 2 อะตอมที่ต่อเนื่องกันอยู่ในตำแหน่งเชิงพื้นที่ในการผสมแบบ sp เชิงเส้น ความยาวของพันธะนี้อยู่ที่ประมาณ 0.120 นาโนเมตร ตัวอย่างเช่น ในเอทไทน์ คาร์บอนไฮบริดหนึ่งตัวจะเชื่อมกับออร์บิทัลของอะตอมไฮโดรเจนเพื่อผลิตพันธะโควาเลนต์ซิกมา sp-s (δ sp-s ) ในทางกลับกัน จับด้วยพันธะซิกมาแบบ sp-sp (δ sp-sp ) ทำให้เกิดลูกผสมอีกตัวที่เข้าร่วมกับอะตอมไฮโดรเจน การเปลี่ยนแปลงดังกล่าวส่งผลให้เกิดการสร้างกรอบเชิงเส้นของโมเลกุล เนื่องจากการผสมแบบ sp ที่เป็นผล ทำให้มีออร์บิทัล p สองวงที่ตั้งฉากกับแกนพันธะ ซึ่งในที่สุดแล้วจะเกิดพันธะ π สองอันระหว่างอะตอมของคาร์บอน ไม่มีการหมุนรอบพันธะสาม
Alkynes – ระบบการตั้งชื่อ
มีหลักการพื้นฐานหลายประการที่ต้องปฏิบัติตามเมื่อตั้งชื่อสารประกอบทางเคมีเหล่านี้:
- การมีอยู่ของพันธะสามชนิดไม่อิ่มตัวในโครงสร้างถูกระบุโดยส่วนต่อท้าย ‘-yne’ แทนที่ส่วนต่อท้าย ‘-ane’ ในชื่อของอัลเคนที่คล้ายคลึงกัน ในกรณีที่เป็นไปได้หลายตำแหน่งของพันธะดังกล่าว คำต่อท้าย ‘-yne’ นำหน้าหมายเลขที่เกี่ยวข้องเสมอ เพื่อระบุตำแหน่งพันธะ เช่น hept-2-yne หรือ hept-1-yne ตำแหน่งที่ตั้งอาจวางไว้ที่ตำแหน่งเริ่มต้นของชื่อ เช่น 1-butyne
- สำหรับโครงสร้างที่มีพันธะสามมากกว่าหนึ่ง จะมีการเพิ่มคำนำหน้าในส่วนต่อท้ายเพื่อระบุจำนวน เหล่านี้จะเป็น -di, -tri ฯลฯ ตามลำดับ
- การกำหนดเลขอะตอมของคาร์บอนจะต้องเป็นไปตามทิศทางที่โซ่หลักมีอะตอมของคาร์บอนมากที่สุดเท่าที่จะเป็นไปได้เช่นเดียวกับพันธะสาม
- ในกรณีที่พันธะไม่อิ่มตัวเพียงพันธะเดียวคือพันธะสาม อะตอมของคาร์บอนจะต้องถูกนับเพื่อให้มีจำนวนต่ำสุดที่เป็นไปได้ กฎนี้ใช้ไม่ได้หากมีพันธะอื่นที่ไม่อิ่มตัว (double) ซึ่งในกรณีนี้จะต้องมีตำแหน่งที่ต่ำที่สุดเท่าที่จะเป็นไปได้
- ในชื่อของสารประกอบที่มีพันธะสาม 1 พันธะถัดจากตำแหน่งแรก สามารถละจำนวนได้ หรืออีกนัยหนึ่ง อาจใช้ชื่อ prop-1-yne เช่นเดียวกับชื่อ propyne
คุณสมบัติทางเคมีฟิสิกส์ของอัลไคน์
ธรรมชาติของแอลคีนไม่มีขั้ว ไม่ชอบน้ำ และทำปฏิกิริยากับน้ำ อย่างพึงประสงค์ พวกมันละลายในตัวทำละลายไม่มีขั้วที่คล้ายกัน เช่น แอลเคน เมื่อโซ่คาร์บอนยาวขึ้น จุดหลอมเหลว จุดเดือด และความหนาแน่นของพวกมันก็เพิ่มขึ้น อย่างไรก็ตามกิจกรรมของพวกเขาลดลงในเวลาเดียวกัน ปฏิกิริยามากที่สุดคือปฏิกิริยาที่มีอะตอมของคาร์บอนน้อยที่สุดในสายโซ่ เมื่อเทียบกับแอลเคนและแอลคีน พวกมันมีปฏิกิริยามากกว่าเล็กน้อยเนื่องจากพันธะสามมีค่าน้อยกว่าพันธะเดี่ยวหรือพันธะคู่ โครงสร้างโมเลกุลของพวกมันยังส่งผลให้สารประกอบเหล่านี้ติดไฟได้สูง ปฏิกิริยาลักษณะหนึ่งของอัลไคน์คือปฏิกิริยาของการเผาไหม้ พวกมันสามารถเพิ่มรีเอเจนต์อิเล็กโทรฟิลิกที่ตำแหน่งของพันธะไม่อิ่มตัว พวกเขาผ่านปฏิกิริยาโพลีเมอไรเซชัน
อนุกรมที่คล้ายคลึงกันของอัลไคน์
เช่นเดียวกับแอลเคนและแอลคีน แอลไคน์ยังมีอนุกรมที่เหมือนกันของมันเอง กล่าวคือ ลำดับชั้นของสารประกอบพื้นฐาน ซึ่งมีพันธะสามเพียงหนึ่งพันธะเท่านั้นที่จำแนกตามจำนวนอะตอมของคาร์บอนที่เพิ่มขึ้นในโครงสร้าง สารประกอบที่เริ่มต้นชุดอัลไคน์ที่คล้ายคลึงกันคือเอทไทน์หรือที่เรียกว่าอะเซทิลีนซึ่งมีอะตอมของคาร์บอนสองอะตอมและอะตอมของไฮโดรเจนสองอะตอมในโครงสร้าง
| จำนวนอะตอมของคาร์บอนในห่วงโซ่ | สูตรอัลเคน | ชื่อแอลเคน | สูตรอัลไคน์ | ชื่อแอลคีน |
| 2 | ซี 2 เอช 6 | อีเทน | ซี 2 เอช 2 | เอทธีน |
| 3 | ซี 3 เอช 8 | โพรเพน | ซี 3 เอช 4 | โพรพิลีน |
| 4 | ซี 4 เอช 10 | บิวเทน | ซี 4 เอช 6 | บิวทีน |
| 5 | ค 5 เอช 12 | เพนเทน | ค 5 เอช 8 | เพนทีน |
| 6 | ค 6 ห 14 | เฮกเซน | ค 6 ห 10 | เฮกซีน |
| 7 | ค 7 ห 16 | เฮปเทน | ค 7 ห 12 | เฮปไทน์ |
| 8 | ค 8 เอช 18 | ออกเทน | ค 8 ห 14 | ออกไทน์ |
| 9 | ค 9 เอช 20 | โนเน่ | ค 9 ห 16 | ไม่มี |
| 10 | ค 10 เอช 22 | เดเคน | ค 10 ฮ 18 | ปฏิเสธ |
การได้รับอัลคีนตามที่เห็นได้จากเอทไทน์
- ปฏิกิริยาของคาร์ไบด์กับน้ำ:
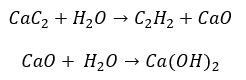
- ไพโรไลซิส:
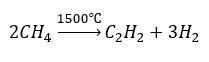
- การสังเคราะห์ที่อุณหภูมิสูง:
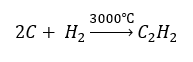
- ออกซิเดชันบางส่วนของก๊าซธรรมชาติ:
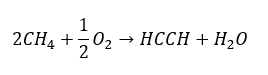
อัลไคน์ที่สูงกว่าจะได้รับในระดับอุตสาหกรรมโดยใช้เอทไทน์เป็นรีเอเจนต์และตัวอย่างเช่น ฟอร์มาลดีไฮด์ในปฏิกิริยาการควบแน่น อีกวิธีหนึ่งคือการกำจัดไฮโดรเจนเฮไลด์สองเท่าจากอัลคิลเฮไลด์ที่เกี่ยวข้องซึ่งมีฮาโลเจนสองอะตอมและติดอยู่กับอะตอมของคาร์บอนหนึ่งอะตอมหรือกับอะตอมของคาร์บอนที่อยู่ติดกัน ในกรณีหลัง มีสองผลิตภัณฑ์ที่เป็นไปได้: แอลไคน์และไดอีน ด้านล่างนี้คือตัวอย่างปฏิกิริยาของการก่อตัวของโพรพีน: 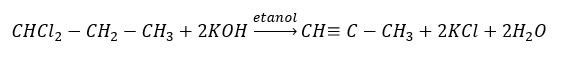
ลักษณะปฏิกิริยาสำหรับอัลคีน:
- การเผาไหม้ทั้งหมดด้วยการสร้างก๊าซคาร์บอนไดออกไซด์:
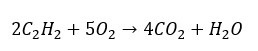
- การเผาไหม้บางส่วนด้วยการสร้างคาร์บอนมอนอกไซด์หรือเขม่า:
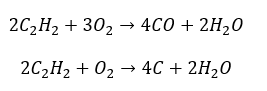
- ปฏิกิริยาไฮโดรจีเนชันโดยมีตัวเร่งปฏิกิริยาที่เป็นโลหะ (Pd, Pt, Fe, Ni) ทำให้เกิดอัลคีน อาจเกิดขึ้นเป็นขั้นๆ โดยมีการเติมไฮโดรเจนทีละโมเลกุลอย่างต่อเนื่อง หรือทั้งหมดในคราวเดียวด้วยการก่อตัวของอัลเคน:
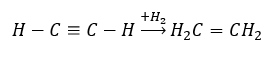
- ปฏิกิริยา Kucherov ซึ่งเป็นลักษณะทั่วไปของอัลไคน์เกี่ยวข้องกับการเติมอนุภาคน้ำในบริเวณพันธะสามซึ่งเกิดขึ้นในสองขั้นตอน ในขั้นต้น enol ที่ไม่เสถียรจะเกิดขึ้น ซึ่งเป็นส่วนผสมของอัลคีนและแอลกอฮอล์ จากนั้นจะผ่านกระบวนการ keto-enol tautomerism นั่นคือการจัดกลุ่มใหม่ด้วยการก่อตัวของ aldehydes หรือ ketones การแปลงจะดำเนินการโดยกลไกอิเล็กโทรฟิลิก:
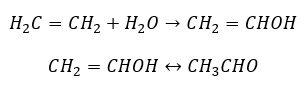
- ปฏิกิริยาการเติมอิเล็กโทรฟิลิกด้วย HCl หรือ HBr ซึ่งเกิดขึ้นตามกฎของ Markovnikov อาจเกิดขึ้นทั้งหมดหรือหลายขั้นตอน
- การเติมโบรมีนด้วยไฟฟ้าด้วยการผลิตอนุพันธ์ของไดหรือเตตระโบรโม เนื่องจากปฏิกิริยากับโบรมีน แอลไคน์จึงเปลี่ยนสีโบรมีนของน้ำ พวกเขายังทำปฏิกิริยากับอนุภาค คลอรีน
- ปฏิกิริยาการเติมฟลูออไรด์อนุมูลอิสระซึ่งดำเนินการภายใต้อิทธิพลของพลังงานแสง
- ปฏิกิริยาการแทนที่ซึ่งอะตอมของไฮโดรเจนที่อะตอมของคาร์บอนที่มีพันธะสามถูกแทนที่ด้วยอะตอมของโลหะ
- ไตรเมอร์ไรเซชัน ได้แก่ โพลิเมอไรเซชันที่มีสามโมเลกุล โดยใช้อะเซทิลีน ซึ่งช่วยให้สามารถสังเคราะห์เบนซีนได้
