Ayrışma, kimyasal bağlamda, bir maddenin diğer moleküllere ayrışması anlamına gelir. Kelime, "ayrılma" anlamına gelen Latince " dissociatio " teriminden gelir. Dissosiyasyonun psikolojide kendine özgü bir anlamı olduğu gibi bilimsel terminolojide de çeşitli tanımları vardır. Ama kimyada ayrışmanın ne anlama geldiğine odaklanalım. İşlemin seyrine ve kullanılan maddeye bağlı olarak dört farklı ayrışma türü ayırt edebiliriz. En popüler olanı elektrolitik ayrışmadır, ancak termal ayrışma da eşit derecede önemlidir.

termal ayrışma
İşlem, sıcaklığın etkisi altında moleküllerin daha küçük moleküllere veya atomlara ayrışmasından oluşur. En önemli ilişki, bileşik daha zayıf kimyasal bağlar içeriyorsa, ayrışma için kullanılan sıcaklığın daha düşük olabileceği gerçeğidir. Ayrışma için gerekli enerjileri daha yüksek olanlar daha yüksek sıcaklık gerektirir. Termolizin (termal ayrışma) yaygın bir örneği, sakarozun 160 oC’de meydana gelen karamelleşmesidir.
elektrolitik ayrışma
1887’de İsveçli kimyager Svante Arrhenius tarafından keşfedildi, termal ayrışmaya kıyasla biraz daha karmaşık. Elektrolitik ayrışma, bir çözücü (genellikle su) serbestçe hareket eden iyonları etkilediğinde meydana gelen bir maddenin ayrışmasından oluşur. Arrhenius, araştırmasında bu tür bir ayrışma ile üretilen iyonların çözeltinin elektriği iletmesine neden olduğunu kanıtladı. Bu, kimyasal maddelerin elektrolitler (elektrik akımını iletebilen çözeltiler) ve elektrolit olmayanlar (elektrik akımını iletemeyen çözeltiler) olarak sınıflandırılmasının geliştirilmesinin temeliydi.
elektrolitler
"Elektrolit" teriminin iki anlamı vardır – teknik açıdan, elektrotlar arasında iyonik olarak bir yük aktarabilen herhangi bir maddedir. Sonuç olarak, elektrik akımını iyonik olarak iletebilir. Bu terimin diğer, daha kimyasal anlamı, erime veya çözünmenin bir sonucu olarak elektrolitik ayrışmaya uğrayan maddeleri ifade eder. Bu tür çözeltiler (çoğunlukla sulu) elektriği de iletir. Bu tür elektrolitlerin örnekleri, sodyum klorür (sofra tuzu) gibi iyonik bileşikleri ve ayrıca hidroklorik asit veya potasyum hidroksit gibi iyonik olmayan bileşikleri içerir. Spesifik özellikleri göz önüne alındığında, elektrolitler elektrik iletkenleri olarak adlandırılabilir. Bunlar, 1. sınıf iletkenler (metaller, alaşımları ve karbon) ve 2. sınıf iletkenler (baz, asit ve tuz çözeltileri) olarak ayrılabilir.
Elektrolitik ayrışma mekanizması
Dielektrik sabiti yüksek olan bir çözücüde (örneğin, su için 81), kristal bir ağdaki iyonlar arasındaki karşılıklı çekim kuvvetleri önemli ölçüde azalır. Bu, maddenin çözünmesine ve serbestçe hareket eden iyonları çözeltiye salmasına neden olan iyonların koptuğu zamandır. Bu tür işlemler, H2O’nun polar yapısının bir sonucu olan iyonlar ve su molekülleri arasındaki etkileşim nedeniyle de meydana gelir. Nekrasov’a göre, bir elektrolitin iyonik yapıya sahip ayrışması sırasında suyun etki mekanizması şu şekilde başlar: su molekülünün zıt kutbunu çeken, aynı zamanda pozitif iyonu uzaklaştıran maddenin pozitif iyonu. Zıt kutup da aynı şekilde hareket eder ve her iki iyon da çektikleri su molekülleri tarafından çevrelenir. Bu tür bir çekim, elektrolit içindeki iyonların çekici kuvvetini çok daha düşük yapan dipolar moleküller ve iyonlar arasında her iki yönde de meydana gelir. Böylece mekanizma dört ana aşamaya ayrılabilir: polar yapının iyonik yapıya geçişi, iyonik yapının oluşumu ve iyonların hidrasyonu. Ayrışma ile üretilen iyonlar ve çözücü arasındaki bağlara solvatlar denir. Su çözücü ise, bunlara hidrat denir.
hidrasyon kabuğu
İyonun en yakın çevresinde bulunan ve zıt kutuplarıyla yönlenmiş su moleküllerinden oluşan bir kabuktur. Serbest, yüklü kutuplar, iyonun çekim kuvveti çözeltideki moleküler hareket enerjisinden daha zayıf hale gelene kadar daha fazla su katmanını çeker. Kabuk, elektrolit moleküllerinin katyonlara ve anyonlara ayrışmasını kolaylaştırır ve iyonların molekül oluşturmak için yeniden bağlanmasını engelleyen bir bariyer oluşturur. 
Asitlerin ve bazların ayrışması: kütle eylemi yasası
Güçlü asitler, sulu bir çözeltide geniş kapsamlı ayrışma gösteren asitlerdir ve zayıf asitler, yalnızca küçük bir ölçüde ayrışan asitlerdir. Farklı asitlerin kuvvetlerini karşılaştırırsak, asit moleküllerinin protonlarını verme eğilimleri veya söz konusu maddenin konsantrasyonu gibi birkaç faktörü de dikkate almalıyız. Bununla birlikte, konsantrasyona bağlı olmayan, ancak moleküllerin bireysel özelliklerini mükemmel bir şekilde karakterize eden bir kimyasal değer vardır – ayrışma sabiti. Bu değer için denklemin türetilmesi, asit ayrışması için denklem yazılarak başlatılmalıdır. Tek protonlu (HX) bir örnek için şöyle görünecektir: ![]() Çözelti seyreltilmiş ve asit zayıfsa, aşağıdaki gibi ifade edilen kütle etkisi yasasını uygulayabiliriz:
Çözelti seyreltilmiş ve asit zayıfsa, aşağıdaki gibi ifade edilen kütle etkisi yasasını uygulayabiliriz: 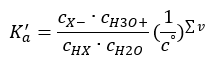 Sunulan ilişkiyi kısaltmanın iki yolu vardır. İlk adım, su konsantrasyonunun sabit olduğunu varsaymaktır. 1 mol/ dm3’e eşit standart bir konsantrasyonu ifade ettiği için co sembolünü de atlayabiliriz. Ancak başlangıç formülünde yer alması ve birim belirlenirken dikkate alınması önemlidir. Bunun nedeni, kimyasal sabitlerin boyutsuz değerler olmasıdır. Bu arada formülde kullanılan tüm konsantrasyonlar mol / dm3 olarak ifade edilmiştir. Sonra nihayet ayrışma sabiti için formülü elde ederiz:
Sunulan ilişkiyi kısaltmanın iki yolu vardır. İlk adım, su konsantrasyonunun sabit olduğunu varsaymaktır. 1 mol/ dm3’e eşit standart bir konsantrasyonu ifade ettiği için co sembolünü de atlayabiliriz. Ancak başlangıç formülünde yer alması ve birim belirlenirken dikkate alınması önemlidir. Bunun nedeni, kimyasal sabitlerin boyutsuz değerler olmasıdır. Bu arada formülde kullanılan tüm konsantrasyonlar mol / dm3 olarak ifade edilmiştir. Sonra nihayet ayrışma sabiti için formülü elde ederiz: 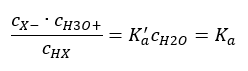 Asit ayrışma sabitini (Ka) ifade eden ilişki, deneyle belirlenen ve 10-10 ila 108 aralığına giren değerlerden oluşur. Popüler bir işlem, ayrışma sabitinin negatif bir logaritması olarak ifade edilen ve pKa : pKa = -logKa olarak gösterilen logaritmik bir formül kullanmaktır . Düşük Ka değerlerinin zayıf asitleri ve yüksek değerlerin güçlü asitleri temsil etmesi önemlidir. , pK a ters yönde değişir. Düşük, genellikle negatif pKa değerleri güçlü asitlere karşılık gelir. Pozitif, yüksek pKa değerleri zayıf asitleri temsil eder. Başka bir kavramı tanıttığımızda, ayrışma derecesi (α), belirli bir bileşiğin ayrışmaya (iyonlara ayrışmaya) uğrayan moleküllerinin mol sayısının moleküllerin toplam mol sayısına oranıdır. çözeltide bulunan bu bileşik, denklemi daha da geliştirebiliriz. Suyun ayrışmasıyla oluşan çok düşük hidrojen iyonları konsantrasyonunu göz ardı edersek ve iyonların ve moleküllerin denge konsantrasyonlarını kullanırsak, şunu varsayabiliriz:
Asit ayrışma sabitini (Ka) ifade eden ilişki, deneyle belirlenen ve 10-10 ila 108 aralığına giren değerlerden oluşur. Popüler bir işlem, ayrışma sabitinin negatif bir logaritması olarak ifade edilen ve pKa : pKa = -logKa olarak gösterilen logaritmik bir formül kullanmaktır . Düşük Ka değerlerinin zayıf asitleri ve yüksek değerlerin güçlü asitleri temsil etmesi önemlidir. , pK a ters yönde değişir. Düşük, genellikle negatif pKa değerleri güçlü asitlere karşılık gelir. Pozitif, yüksek pKa değerleri zayıf asitleri temsil eder. Başka bir kavramı tanıttığımızda, ayrışma derecesi (α), belirli bir bileşiğin ayrışmaya (iyonlara ayrışmaya) uğrayan moleküllerinin mol sayısının moleküllerin toplam mol sayısına oranıdır. çözeltide bulunan bu bileşik, denklemi daha da geliştirebiliriz. Suyun ayrışmasıyla oluşan çok düşük hidrojen iyonları konsantrasyonunu göz ardı edersek ve iyonların ve moleküllerin denge konsantrasyonlarını kullanırsak, şunu varsayabiliriz: 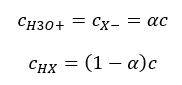 Daha sonra ayrışma sabiti aşağıdaki gibi not edilebilir:
Daha sonra ayrışma sabiti aşağıdaki gibi not edilebilir:  Bu formda, bir elektrolitin ayrışma derecesinin konsantrasyonuna bağımlılığıdır, yani Ostwald’ın seyreltme kanunu. Çok zayıf elektrolitleri analiz edersek, ayrışma derecesi (α) <<1 olarak kabul edilebilir ve formül aşağıdaki gibi basitleştirilebilir:
Bu formda, bir elektrolitin ayrışma derecesinin konsantrasyonuna bağımlılığıdır, yani Ostwald’ın seyreltme kanunu. Çok zayıf elektrolitleri analiz edersek, ayrışma derecesi (α) <<1 olarak kabul edilebilir ve formül aşağıdaki gibi basitleştirilebilir:  Birden fazla proton içeren asitler çok aşamalı ayrışmaya uğrar ve tüm aşamalarını hesaba katmalıyız. Örnek vermek gerekirse, ortofosforik asit için üç aşama vardır:
Birden fazla proton içeren asitler çok aşamalı ayrışmaya uğrar ve tüm aşamalarını hesaba katmalıyız. Örnek vermek gerekirse, ortofosforik asit için üç aşama vardır:
- H 3 PO 4 + H 2 O = H 2 PO 4 – + H 3 O +
- H 2 PO 4 – + H 2 O = HPO 4 2- + H 3 O +
- HPO 4 2- + H 2 O = PO 4 3- + H 3 O +
Her aşamanın kendi denge sabiti vardır ve bu, birinciye benzer şekilde not edilebilir:  Ayrışma sabitleri, hem hidrasitler hem de oksiasitler için tablo halinde verilmiştir.
Ayrışma sabitleri, hem hidrasitler hem de oksiasitler için tablo halinde verilmiştir.
| Asit | ka | pK bir |
| HF | 6,3·10 -4 | 3.2 |
| HCI | 1.10 7 | -7 |
| HNO3 | 27.54 | -1.44 |
| H3PO4 _ | 6.9·10 -3 | 2.16 |
Tablo 1. Asitler için ayrışma sabitlerinin örnek değerleri. Ayrışma sırasında bazların dengesinin stabilizasyonu için benzerdir. Örnek kural B göz önüne alındığında, denklem aşağıdaki gibi not edilebilir: ![]() Daha sonra, kütle hareket yasasını kullanarak ve seyreltilmiş çözeltideki su konsantrasyonunun hemen hemen sabit olduğunu varsayarak bir baz için bir ayrışma sabiti türetmek istiyorsak, aşağıdaki formülü elde ederiz:
Daha sonra, kütle hareket yasasını kullanarak ve seyreltilmiş çözeltideki su konsantrasyonunun hemen hemen sabit olduğunu varsayarak bir baz için bir ayrışma sabiti türetmek istiyorsak, aşağıdaki formülü elde ederiz:  Baz ne kadar güçlüyse, ayrışma sabiti o kadar yüksek ve pKb değeri o kadar düşükken, ayrışma sabiti ne kadar düşük ve pKb değeri ne kadar yüksekse, baz o kadar zayıftır.
Baz ne kadar güçlüyse, ayrışma sabiti o kadar yüksek ve pKb değeri o kadar düşükken, ayrışma sabiti ne kadar düşük ve pKb değeri ne kadar yüksekse, baz o kadar zayıftır.
| Temel | kb | pk b |
| hidrazin | 3·10 -6 | 5.5 |
| Amonyak | 1,78·10 -5 | 4.75 |
| metilamin | 5.0·10 -4 | 3.3 |
Tablo 2. Bazlar için ayrışma sabitlerinin örnek değerleri. 
Asitlerin gücünü ne belirler
Belirli asitler için ayrışma sabitlerinin ifadelerini bilirsek, birkaç doğru varsayımda bulunabiliriz:
- Hidrasitlerin gücü, hidrojen atomuna bağlı elementin artan atom numarasıyla birlikte artar.
- Hidrasitlerin gücü, hidrojen atomuna bağlı elementin artan elektronegatifliği ile birlikte azalır. Teoride artan elektronegatiflik protonların soyutlanmasını desteklemesi gerektiğinden, bu yanıltıcı olabilir.
- Ayrışma sırasında oluşan anyonun boyutu, ayrışma sabitini elektronegatiflikten daha büyük ölçüde etkiler.
Suyun kendi kendine ayrışması
Ayrışmanın ilginç bir örneği, su moleküllerinin ayrışmasıdır. Hem proton çekebildikleri hem de onları verebildikleri için, saf su aşağıdaki denkleme göre küçük bir ölçüde kendi kendine ayrışır: H 2 O + H 2 O ↔ H 3 O + + OH – Asitler için olduğu gibi ve bazlar, ayrışmamış suyun denge konsantrasyonlarının yanı sıra anyonlarını ve katyonlarını içeren kütle etkisi yasasını uygulamak da mümkündür: 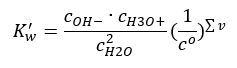 H 3 O + katyonları ve OH – anyonlarının konsantrasyonlarının, ayrışmamış suya kıyasla o kadar küçük olduğu ve bunların değiştirilmesinin bile pratikte ayrışmamış suyun konsantrasyonunu değiştirmediği ortaya çıktı. Bu, değerin sabit olduğunu varsaymayı ve denklemi aşağıdaki forma dönüştürmeyi mümkün kılar: K w = c OH – · c H3O + Bu, kimyasal hesaplamalar bağlamında özellikle önemli bir husustur ve böyle bir sabite atıfta bulunulur. suyun iyonik ürünü olarak. Ayrıca genellikle pKw olarak adlandırılan negatif bir logaritma olarak kullanılır. Bu, –logK w’ye eşittir. Denkleme dayanarak, H 3 O + iyonlarının sağlanmasının bir sonucu olarak suyun iyonik dengesi bozulursa, iyonik ürünün sabitliğini korumak için OH – iyonlarının konsantrasyonunu azaltmamız gerekir. Benzer şekilde, aşırı OH – iyonları katyonların konsantrasyonunu azaltır. Bu konsantrasyonların ürünü sabit olmalıdır. Deneyler, Kw’nin 298K sıcaklıkta 10-14 olduğunu göstermiştir. Bu nedenle, saf su için geçerli olan denklemi şu şekilde de not edebiliriz:
H 3 O + katyonları ve OH – anyonlarının konsantrasyonlarının, ayrışmamış suya kıyasla o kadar küçük olduğu ve bunların değiştirilmesinin bile pratikte ayrışmamış suyun konsantrasyonunu değiştirmediği ortaya çıktı. Bu, değerin sabit olduğunu varsaymayı ve denklemi aşağıdaki forma dönüştürmeyi mümkün kılar: K w = c OH – · c H3O + Bu, kimyasal hesaplamalar bağlamında özellikle önemli bir husustur ve böyle bir sabite atıfta bulunulur. suyun iyonik ürünü olarak. Ayrıca genellikle pKw olarak adlandırılan negatif bir logaritma olarak kullanılır. Bu, –logK w’ye eşittir. Denkleme dayanarak, H 3 O + iyonlarının sağlanmasının bir sonucu olarak suyun iyonik dengesi bozulursa, iyonik ürünün sabitliğini korumak için OH – iyonlarının konsantrasyonunu azaltmamız gerekir. Benzer şekilde, aşırı OH – iyonları katyonların konsantrasyonunu azaltır. Bu konsantrasyonların ürünü sabit olmalıdır. Deneyler, Kw’nin 298K sıcaklıkta 10-14 olduğunu göstermiştir. Bu nedenle, saf su için geçerli olan denklemi şu şekilde de not edebiliriz:  Ayrışma ayrıca çözeltinin pH değeri ile de ilgilidir. Eşit konsantrasyonlarda H3O + katyonları ve OH – anyonları olan çözeltiler nötr bir pH gösterir. Asidik çözeltilerde katyon konsantrasyonu 10 -7 mol/l’den yüksek, alkali çözeltilerde ise 10 -7 mol/l’den düşüktür.
Ayrışma ayrıca çözeltinin pH değeri ile de ilgilidir. Eşit konsantrasyonlarda H3O + katyonları ve OH – anyonları olan çözeltiler nötr bir pH gösterir. Asidik çözeltilerde katyon konsantrasyonu 10 -7 mol/l’den yüksek, alkali çözeltilerde ise 10 -7 mol/l’den düşüktür.
























































































































