En az iki maddenin homojen karışımı çözelti olarak kabul edilir. Çözeltiyi esas olarak sıvı olarak düşünsek de, gaz ve katı karışımlar da birer çözeltidir. Bununla birlikte, sulu bir ortamda hem laboratuvar hem de endüstriyel ölçekte çok büyük bir kimyasal reaksiyon grubu meydana gelir. Üç tür sıvı çözelti vardır - çözücü her zaman sıvıdır, ancak çözünen gaz, sıvı veya katı olabilir. Örnekler arasında sulu hidrojen klorür, etanol ve mutfak tuzu çözeltileri bulunur.

Çözeltinin bileşimini açıklama
Herhangi bir çözümün en önemli özelliği, bileşiminin tanımıdır. Bir çözeltinin bileşimini belirleme ve ilgilenilen birimlere göre yeniden hesaplama yeteneği, her kimyacının temel becerisidir. Bir karışımdaki belirli bir bileşenin miktarı, örneğin kütle, hacim veya molarite gibi çeşitli şekillerde tanımlanabilir. Bu nedenle, bileşen miktarının çözelti veya karışım miktarına bağımlılığını tanımlayan çeşitli konsantrasyon türleri de vardır. Çoğu zaman, çözeltilerin bileşimini tanımlarken şu terimleri kullanırız: kütle fraksiyonu, hacim fraksiyonu, mol fraksiyonu ve molar konsantrasyon. Kesirler, ilgilenilen içeriğin belirli bir karışımın hangi kısmını oluşturduğunu gösterir. Bileşiğin kütle, hacim veya mol birimlerinde ifade edilebilirler.
Molar konsantrasyon
Bu, çözeltinin hacminde bulunan maddenin mol sayısını belirleyerek kullanım kolaylığı nedeniyle en sık seçilen konsantrasyondur. Teorik temel, aynı sıcaklıkta ve aynı konsantrasyon ve hacimdeki iki farklı maddenin çözeltilerinin aynı sayıda mol ve dolayısıyla aynı sayıda çözünen molekülü içerdiği ifadesidir. Bu ilişkiye dayanarak, eşit molar konsantrasyonlara sahip çözeltiler için, stokiyometrik katsayılar tarafından belirlenen mol sayısının doğru oranını elde etmek için uygun hacimlerde çözeltileri karıştırmak mümkündür. Bu, A + B → C tipi reaksiyonları düşünürsek, bir mol A maddesinin bir mol B maddesiyle reaksiyona girdiği durumlarda, reaksiyonun tam olarak ilerlemesi için her iki çözeltinin aynı molar konsantrasyona sahip eşit hacimlerde karıştırılması gerektiği anlamına gelir. A + 2B → C tipi reaksiyon, yani bir mol A maddesinin iki mol B maddesi ile reaksiyona girmesi durumunda, bir hacim A çözeltisi iki hacim B çözeltisi ile karıştırılmalıdır. Bu durumda başka bir çözelti daha vardır, çünkü 1:2 hacim oranında eşmolar çözeltiler kullanmak yerine, konsantrasyonun iki katı olan bir hacim A çözeltisi ve bir hacim B çözeltisi kullanılabilir. Cm ile gösterilen molar konsantrasyon, bir çözeltinin bir hacim biriminde, çoğunlukla 1 dm3’te bulunan bir maddenin mol sayısını tanımlar. Molar konsantrasyonun hesaplanmasını sağlayan formül, maddenin mol sayısı (n s ) ile çözeltinin toplam hacminin (V sol ) dm3 cinsinden bölümüdür: 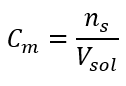 SI sistemine göre temel hacim birimi yani metreküp kullanılırken, maddenin miktar birimi olarak kilomol kullanılmalıdır. Ancak, bu büyük bir hesaplama sorunu değildir, çünkü
SI sistemine göre temel hacim birimi yani metreküp kullanılırken, maddenin miktar birimi olarak kilomol kullanılmalıdır. Ancak, bu büyük bir hesaplama sorunu değildir, çünkü 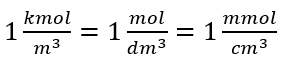 . Molar konsantrasyon birimi Cm , mol/desimetreküp olarak tanımlanır ve genellikle M olarak belirtilir. 1 mol/dm 3 = 1M
. Molar konsantrasyon birimi Cm , mol/desimetreküp olarak tanımlanır ve genellikle M olarak belirtilir. 1 mol/dm 3 = 1M 
Molar konsantrasyonun kullanımı
a) Çözeltideki bileşen içeriğine dayalı olarak molar konsantrasyonun hesaplanması Örnek 1. Çözelti, çözeltinin 3.0 dm3’ünde 30 g potasyum hidroksit içerir. Molar konsantrasyonunu hesaplayın. Adım 1. KOH molar kütlesinin hesaplanması 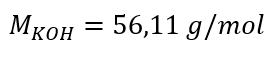 Adım 2. Çözeltideki KOH mol sayısının hesaplanması
Adım 2. Çözeltideki KOH mol sayısının hesaplanması 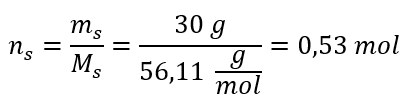 Adım 3. Molar konsantrasyonun formül kullanılarak hesaplanması
Adım 3. Molar konsantrasyonun formül kullanılarak hesaplanması 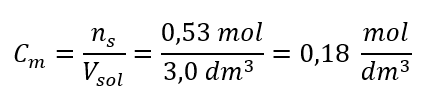 Yanıt: Çözeltinin 3,0 dm3’ünde 30 g madde içeren bir potasyum hidroksit çözeltisinin molar konsantrasyonu Cm =
Yanıt: Çözeltinin 3,0 dm3’ünde 30 g madde içeren bir potasyum hidroksit çözeltisinin molar konsantrasyonu Cm = 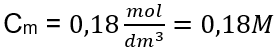 b) Belirli bir konsantrasyonda bir çözeltinin hazırlanması Örnek 2. 0.32 mol/ dm3’lük bir konsantrasyonda 300 cm3’lük bir çözeltinin hazırlanması için gerekli glikoz ( C6H12O6 ) kütlesini hesaplayın. Adım 1. Molar glikoz kütlesinin hesaplanması
b) Belirli bir konsantrasyonda bir çözeltinin hazırlanması Örnek 2. 0.32 mol/ dm3’lük bir konsantrasyonda 300 cm3’lük bir çözeltinin hazırlanması için gerekli glikoz ( C6H12O6 ) kütlesini hesaplayın. Adım 1. Molar glikoz kütlesinin hesaplanması 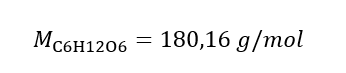 Adım 2. Dönüştürülmüş molar formülü kullanarak gerekli glikoz kütlesinin hesaplanması
Adım 2. Dönüştürülmüş molar formülü kullanarak gerekli glikoz kütlesinin hesaplanması 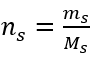 :
: 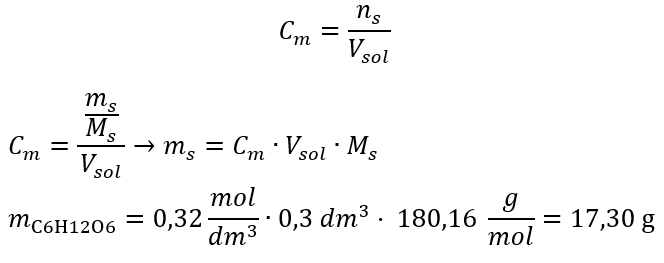 Bu hesaplamalardan sonra, böyle bir çözelti hazırlamak için 17.30 g glikozun tartılması ve kantitatif olarak 300 cm3’lük bir balon jojeye aktarılması gerektiğini biliyoruz. Cevap: Molar konsantrasyonu 0,32 mol/ dm3 olan 300 cm3 glukoz çözeltisi hazırlamak için 17,30 g maddenin tartılması gerekir. c) Konsantre solüsyonların seyreltilmesi ve konsantrasyonu Molar konsantrasyonu kullanarak, konsantre solüsyonu ( Cm1 ) seyrelterek belirli bir konsantrasyonda ( Cm2 ) bir solüsyon da hazırlayabiliriz, burada:
Bu hesaplamalardan sonra, böyle bir çözelti hazırlamak için 17.30 g glikozun tartılması ve kantitatif olarak 300 cm3’lük bir balon jojeye aktarılması gerektiğini biliyoruz. Cevap: Molar konsantrasyonu 0,32 mol/ dm3 olan 300 cm3 glukoz çözeltisi hazırlamak için 17,30 g maddenin tartılması gerekir. c) Konsantre solüsyonların seyreltilmesi ve konsantrasyonu Molar konsantrasyonu kullanarak, konsantre solüsyonu ( Cm1 ) seyrelterek belirli bir konsantrasyonda ( Cm2 ) bir solüsyon da hazırlayabiliriz, burada: 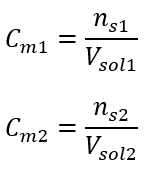 Seyreltme sırasında sadece çözeltinin hacmi değişir, çözünenin mol sayısı değişmez. Yani şu varsayılabilir:
Seyreltme sırasında sadece çözeltinin hacmi değişir, çözünenin mol sayısı değişmez. Yani şu varsayılabilir: ![]() Molar konsantrasyon formülünü dönüştürerek aşağıdaki ilişkileri elde ederiz:
Molar konsantrasyon formülünü dönüştürerek aşağıdaki ilişkileri elde ederiz: 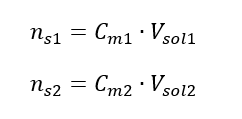 Denklemi elde ettiğimizi bilerek:
Denklemi elde ettiğimizi bilerek: 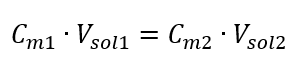 Yeni elde edilen ( Cmx ) de dahil olmak üzere molar konsantrasyon dikkate alınarak çözeltilerin seyreltilmesi için formül şu şekilde not edilebilir:
Yeni elde edilen ( Cmx ) de dahil olmak üzere molar konsantrasyon dikkate alınarak çözeltilerin seyreltilmesi için formül şu şekilde not edilebilir: 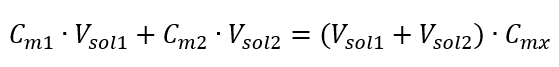 Örnek 3. Bu asidin 0,750 mol/ dm3’lük çözeltisinin 250 cm3’ü su ile seyreltilerek 0,150 mol/ dm3’lük asitin hacmi ne kadar olur? Adım 1. Su konsantrasyonunun Cm2 = 0 mol/ dm3 olduğu varsayımıyla formülün dönüştürülmesi.
Örnek 3. Bu asidin 0,750 mol/ dm3’lük çözeltisinin 250 cm3’ü su ile seyreltilerek 0,150 mol/ dm3’lük asitin hacmi ne kadar olur? Adım 1. Su konsantrasyonunun Cm2 = 0 mol/ dm3 olduğu varsayımıyla formülün dönüştürülmesi. 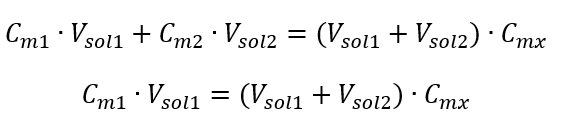 Adım 2. Toplam hacim hesabı ( Vx )
Adım 2. Toplam hacim hesabı ( Vx ) 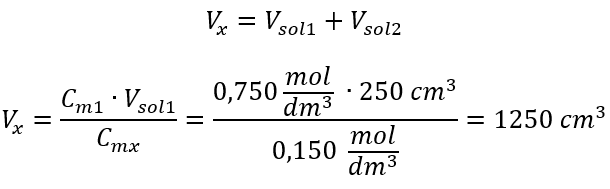 Alternatif olarak, seyreltme sırasında mol sayısının kalıcılık bağıntıları kullanılabilir:
Alternatif olarak, seyreltme sırasında mol sayısının kalıcılık bağıntıları kullanılabilir: 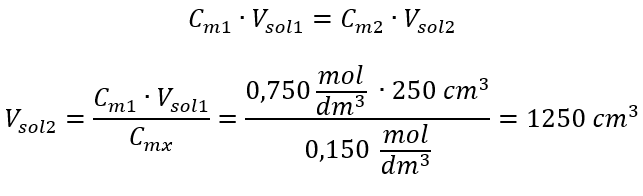 Cevap: Asidi gerekli konsantrasyona seyreltmek için 1,25 dm 3 su kullanılmalıdır. Örnek 4. 1,50 mol/ dm3 derişimli bir çözelti elde etmek için 0,125 mol/ dm3 derişimli 300 cm3’lük bir çözeltiden ne kadar su buharlaştırılması gerektiğini hesaplayın. Adım 1. Suyun molar konsantrasyonunun Cm2 = 0 mol/ dm3 olduğu varsayımıyla molar konsantrasyondaki değişim formülünün dönüştürülmesi.
Cevap: Asidi gerekli konsantrasyona seyreltmek için 1,25 dm 3 su kullanılmalıdır. Örnek 4. 1,50 mol/ dm3 derişimli bir çözelti elde etmek için 0,125 mol/ dm3 derişimli 300 cm3’lük bir çözeltiden ne kadar su buharlaştırılması gerektiğini hesaplayın. Adım 1. Suyun molar konsantrasyonunun Cm2 = 0 mol/ dm3 olduğu varsayımıyla molar konsantrasyondaki değişim formülünün dönüştürülmesi. 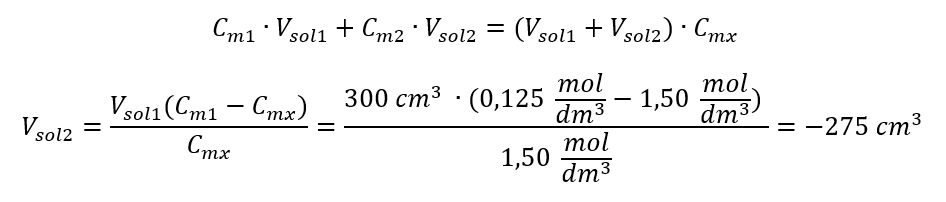 Cevap: Çözeltiyi konsantre hale getirmek için 275 buharlaştırılmalıdır. Molar konsantrasyonun yüzde konsantrasyonuna karşı dönüşümü Günlük laboratuvar çalışmalarında, farklı solüsyon konsantrasyonlarını dönüştürmek gerekir. Çoğu zaman, molar konsantrasyon ve yüzde konsantrasyon kullanılır. Çözeltinin yoğunluğunu kullanarak aralarında geçiş yapmak mümkündür. Bu parametre, ilgilenilen konsantrasyonlar için formüllere eklenmelidir:
Cevap: Çözeltiyi konsantre hale getirmek için 275 buharlaştırılmalıdır. Molar konsantrasyonun yüzde konsantrasyonuna karşı dönüşümü Günlük laboratuvar çalışmalarında, farklı solüsyon konsantrasyonlarını dönüştürmek gerekir. Çoğu zaman, molar konsantrasyon ve yüzde konsantrasyon kullanılır. Çözeltinin yoğunluğunu kullanarak aralarında geçiş yapmak mümkündür. Bu parametre, ilgilenilen konsantrasyonlar için formüllere eklenmelidir: 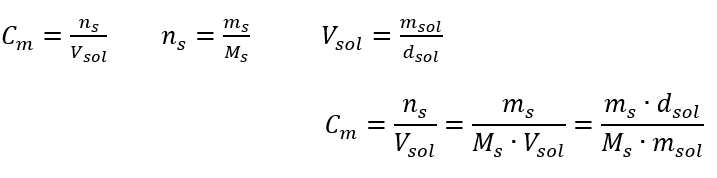 Dönüşümde, formülle ifade edilen yüzde konsantrasyonunun temeli olan madde kütlesinin çözeltinin kütlesine oranını görebiliriz:
Dönüşümde, formülle ifade edilen yüzde konsantrasyonunun temeli olan madde kütlesinin çözeltinin kütlesine oranını görebiliriz: 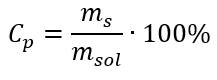 Yüzde konsantrasyon formülünü molar konsantrasyon için daha önce dönüştürülmüş formülle değiştirerek, iki değer arasında serbestçe geçiş yapmamızı sağlayan bir ilişki elde ederiz:
Yüzde konsantrasyon formülünü molar konsantrasyon için daha önce dönüştürülmüş formülle değiştirerek, iki değer arasında serbestçe geçiş yapmamızı sağlayan bir ilişki elde ederiz: 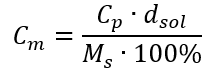 Formülün tek sınırlaması uygun birimlerin kullanılmasıdır, bu nedenle tüm hesaplamalarda bunları dikkate almaya değer. Örnek 5. Yüzde konsantrasyonunun Cp = %98.0 ve yoğunluğunun d = 1.84 kg/ dm3 olduğunu bilerek sülfürik (VI) asidin molar konsantrasyonunu hesaplayın. Bu, iki yöntem kullanılarak hesaplanabilir: Yöntem 1. Bir formül kullanmadan birkaç adımda Adım 1. Asidin 1.00 dm3 kütlesinin hesaplanması
Formülün tek sınırlaması uygun birimlerin kullanılmasıdır, bu nedenle tüm hesaplamalarda bunları dikkate almaya değer. Örnek 5. Yüzde konsantrasyonunun Cp = %98.0 ve yoğunluğunun d = 1.84 kg/ dm3 olduğunu bilerek sülfürik (VI) asidin molar konsantrasyonunu hesaplayın. Bu, iki yöntem kullanılarak hesaplanabilir: Yöntem 1. Bir formül kullanmadan birkaç adımda Adım 1. Asidin 1.00 dm3 kütlesinin hesaplanması 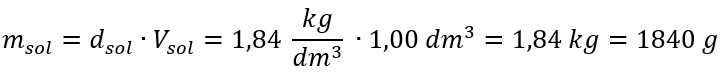 Adım 2. Yüzde konsantrasyonu dikkate alınarak asit kütlesinin hesaplanması
Adım 2. Yüzde konsantrasyonu dikkate alınarak asit kütlesinin hesaplanması 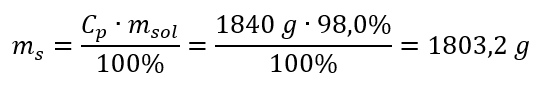 Adım 3. Mol sayısının hesaplanması
Adım 3. Mol sayısının hesaplanması 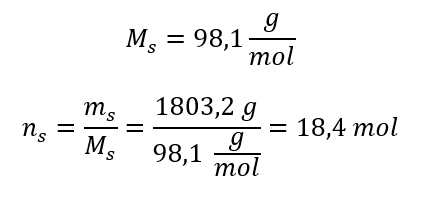 Adım 4. Çözeltinin 1 dm 3’ündeki maddenin mol sayısı olduğunu bilerek molar konsantrasyonun hesaplanması
Adım 4. Çözeltinin 1 dm 3’ündeki maddenin mol sayısı olduğunu bilerek molar konsantrasyonun hesaplanması 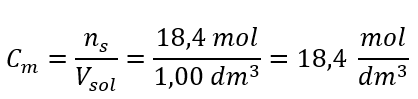 Yöntem 2. Yüzde konsantrasyonu ile molar konsantrasyon arasındaki ilişkinin kullanılması
Yöntem 2. Yüzde konsantrasyonu ile molar konsantrasyon arasındaki ilişkinin kullanılması 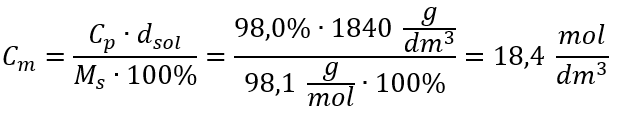 Cevap: Bu asidin molar derişimi 18.4 mol/ dm3’tür .
Cevap: Bu asidin molar derişimi 18.4 mol/ dm3’tür .
