Elektronegatiflik, bir molekül içindeki belirli bir atomun elektronları kendine çekme eğilimini yansıtan bir miktardır. Pratikte bu, bir atomun veya fonksiyonel grupların elektron yoğunluğunu çekme yeteneğidir. Bu miktarla ilgili en yaygın olarak kullanılan ölçek, Linus Pauling tarafından ortaya atılan ve tahvilin yaklaşık yapısının kolayca hesaplanmasını mümkün kılan ölçektir.

Elektronegatiflik özellikleri
Homonükleer moleküller, örneğin H 2 ve O 2 , moleküler yörüngelerinde eşit c A ve c B katsayılarına sahiptir ve bunlar dalga fonksiyonları olarak kaydedilebilir: Ψ +AB = c A Ψ A + c B Ψ B Ψ −AB = c A Ψ A − c B Ψ B Bu durumda, yörünge, şeklinin molekülün merkezine göre simetrik olması ve elektrik yükünün kendi içinde eşit simetrik olarak dağılmasıyla karakterize edilir. Ancak başka bir örnek, molekülün merkezine göre tam simetrinin yanı sıra eşit katsayıları korumanın neredeyse imkansız olduğu heteronükleer moleküllerdir. Atomik yörünge Ψ B’nin enerji seviyesi, atomik yörünge Ψ A’nın enerji seviyesinden daha düşük olduğunda, ilişki meydana gelir ve elektron olasılık yoğunluğunun maksimumu, B atomuna doğru kayar. Pratikte bu, elektronun kaymasıyla sonuçlanır. kimyasal bağdaki çift, yani B atomuna doğru polarizasyon. Örneğin, lityum hidrit molekülü LiH’de bu kayma hidrojen atomuna doğru iken, hidrojen florür molekülü HF’de flor atomuna doğrudur. Bu, hidrojen atomunun lityumdan daha düşük bir enerji seviyesine, ancak flordan daha yüksek bir enerji seviyesine sahip olduğu anlamına gelir ( halojenler hakkında bilgi edinin). Bu koşullar altında, her iki molekülün atomlarından biri -δ ile gösterilen negatif bir yük alırken, diğeri pozitif +δ olur. Böyle bir molekülün genel formülü A +δ B -δ’dır .
Atomların yükleri
Yukarıda belirtilen δ yükü, kimyasal bağın bağlı olduğu elementlere bağlı olarak farklı değerler alabilir. 0 değeri, elektron çiftinin yükünün simetrik olarak dağıldığı ve çiftin tamamen daha düşük enerji seviyesine sahip atomun yakınında yer aldığı ve bunun sonucunda her iki elektronun da o atoma aktarılması anlamına gelir. Bu, elementler arasında iyonik bir bağ oluşturur. Bununla birlikte, kimyasal bağların büyük çoğunluğunda, kovalent ve iyonik bağ arasında bir durumla sonuçlanan kesirli yükler vardır.
Dipol momenti
Bir dipol, iki kutbun (pozitif ve negatif) ayırt edilebildiği bir moleküldür. μ ile gösterilen dipol momenti, içindeki elektrik yükü kaymasının büyüklüğünün bir ölçüsüdür. Kutuplardan birinde bulunan elektrik yükünün (δ) mutlak değeri ile bu kutuplara olan uzaklığın (l) çarpımı olarak tanımlanır: μ = δ · l Bir pozitif yük (δ+) ve bir negatif yük ( δ-) kısmi yük olarak adlandırılır ve konumu belirli bir atoma atfedilir, ancak gerçekte bu, çekirdeklerin etrafında bir elektronun bulunmasının yalnızca daha büyük veya daha az olasılığıdır. Böyle bir olay bazen oksidasyon ve indirgeme süreçleriyle karıştırılır, ancak atomlarda meydana gelen değişimlerden farklı olarak, bu tür yüklerin atomlar tarafından alınması onların başka bir oksidasyon durumuna geçmesine neden olmaz, dolayısıyla aralarında elektron alışverişi olmaz. onlara. Dipol momentini ifade etmek için kullanılan SI birimi coulomb metredir (C·m). Ancak hesaplamalarda en yaygın olarak CGS sisteminde yazılan birim olan debye (D) kullanılmaktadır. Bir debye 3,33564·10 -30 C·m değerine karşılık gelir. Teorik olarak mümkün olan en büyük dipol momenti, molekülleri saf iyonik bağla karakterize eder. Oysa en küçüğü, bağları tamamen kovalent olan moleküllerde meydana gelir; bu durumda dipol momenti sıfırdır. Ancak çoğu, değişen parçacık karakterlerine sahip ara durumlardır.
Halojen dipol momenti
Belirli kimyasal bileşiklerde elektronegatiflik ile dipol momenti arasındaki çeşitli ilişkiler kolaylıkla gözlemlenebilir. Tablo 1 Hidrojen halojenürlerin dipol momentleri
| Birleştirmek | Deneysel olarak belirlenen dipol momenti [ μ, D] | Bağ uzunluğu [pm] | Element yükünün ve dipol uzunluğunun çarpımı [e ·l, D] | İyonik karakterin payı [ %] | Halojen ve hidrojenin elektronegatifliğindeki fark |
| HF | 1.98 | 92 | 4.42 | 45 | 1.9 |
| HC1 | 1.08 | 128 | 6.15 | 18 | 0,9 |
| HBr | 0,79 | 143 | 6.87 | 12 | 0,7 |
| MERHABA | 0,38 | 162 | 7.78 | 5 | 0,4 |
μ/(e·l’) oranı, yani bir iyonik bağa karşılık gelen gerçek dipol momentinin dipol momentine oranı, tam kovalent bağdan sapmaların bir ölçüsünü sağlayabilir. Bu ilişkinin (μ/(e·l’))·100%formundaki ürünü, bağdaki iyonik karakterin yüzdesini temsil eder. Bu sadece yaklaşık bir değerdir çünkü dipol momenti sadece bağın polaritesine değil aynı zamanda serbest elektron çiftlerinin davranışına da bağlıdır. Elektron bulutu molekülün dışına kaydırılabilir, bunun sonucunda dipol momentini belirleyen denklemin ek bir bileşeni vardır. Amonyak molekülü durumunda bulut, bağın dipol momentiyle aynı doğrultuda yönlendirilir ve sonuçta ortaya çıkan dipol momentinde bir artış olur. Buna karşılık, karbon monoksit molekülü için bunun tersi doğrudur; bulut ters yöne yönlendirilir ve sonuç olarak ortaya çıkan dipol momenti azalır. 
Elektronegatiflik
Bir molekül içindeki belirli bir atomun elektronları kendine çekme eğilimini yansıtan boyutsuz ampirik bir niceliktir. Pratikte bu, bir atomun veya fonksiyonel grupların elektron yoğunluğunu çekme yeteneğidir. Bu miktarla ilgili en yaygın kullanılan ölçek, Linus Pauling tarafından ortaya atılan ve tahvilin yaklaşık yapısının kolayca hesaplanmasını mümkün kılan ölçektir. Bilim adamı, bireysel elementlerin elektronegatifliğini hesaplamak için aşağıdaki yöntemi kullandı: D AA ve D BB’nin iki atomlu moleküllerin (A 2 , B 2 ) bağ enerjileri olduğunu varsayıyoruz. Molekülde oluşan bağlanma enerjisini DAB olarak adlandırıyoruz. Ampirik olarak, eğer böyle bir bağ çok az iyonik karakter içeriyorsa veya hiç iyonik karakter içermiyorsa, D AB değerleri ile D AA ve D BB enerji değerlerinin geometrik ortalaması arasındaki farkın sıfıra eşit veya sıfıra yakın olduğu gösterilmiştir. AB bağının kovalent karakterden belirgin sapmaları olduğunda, bu fark pozitif değerler alır ve iyonik karakterin oranı arttıkça bu değerler artar. Bağda yer alan iki atomun elektronegatifliği (x) arasındaki fark aşağıdaki formülle ifade edilir: ![]() Dolayısıyla, eğer Pauling hesaplamalarında florun elektronegatifliğini 4,0 olarak varsaydı, elementlerin sonraki elektronegatifliklerini hesaplamak mümkündü. A elementinin atomlarının x A değerini ve Δ’ katsayısının değerini biliyorsak, yukarıdaki denklemi kullanarak x B değerini hesaplayabiliriz. Pauling ölçeği, hidrojen halojenürler için belirlenen değerleri içeren Tablo 1’deki örnekten de görebileceğimiz gibi, değerleri söz konusu atomların oluşturduğu bağın dipol momentinin değerleriyle yaklaşık olarak uyum sağlayacak şekilde yapılandırılmıştır. . Yukarıda açıklanan ölçeğe ek olarak, bilimsel literatürde açıklanan elektronegatiflik de dahil olmak üzere birkaç tane daha vardır:
Dolayısıyla, eğer Pauling hesaplamalarında florun elektronegatifliğini 4,0 olarak varsaydı, elementlerin sonraki elektronegatifliklerini hesaplamak mümkündü. A elementinin atomlarının x A değerini ve Δ’ katsayısının değerini biliyorsak, yukarıdaki denklemi kullanarak x B değerini hesaplayabiliriz. Pauling ölçeği, hidrojen halojenürler için belirlenen değerleri içeren Tablo 1’deki örnekten de görebileceğimiz gibi, değerleri söz konusu atomların oluşturduğu bağın dipol momentinin değerleriyle yaklaşık olarak uyum sağlayacak şekilde yapılandırılmıştır. . Yukarıda açıklanan ölçeğe ek olarak, bilimsel literatürde açıklanan elektronegatiflik de dahil olmak üzere birkaç tane daha vardır:
- Mulliken’in çalışması, bir elementin elektronegatifliğinin, elektron ilgisi ve iyonlaşma enerjisinin toplamı ile doğru orantılı olduğunu varsaydı. Bir elektronun nötr bir atoma bağlanması nedeniyle açığa çıkan enerji miktarı olan elektron ilgisi ve iyonlaşma enerjisi, bir elektronun nötr bir atomdan ayrılması için gereken enerji miktarına eşittir. Bu nedenle en yüksek elektronegatiflikler, yüksek elektron ilgisi ve yüksek iyonlaşma enerjisi sergileyen atomlar için karakteristiktir.
- Elektronegatifliğin atom çekirdeğinin (Z) değerlik elektronlarına uyguladığı kuvvetin ölçüsüyle orantılı olduğunu varsayan Allred ve Rochow, şu şekilde kaydetti:
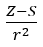 (r – atom yarıçapı, S – tarama sabiti). Teorilerine göre elementlerin elektronegatifliği (x) aşağıdaki formül kullanılarak hesaplanabilir:
(r – atom yarıçapı, S – tarama sabiti). Teorilerine göre elementlerin elektronegatifliği (x) aşağıdaki formül kullanılarak hesaplanabilir:
![]() Her ölçekte hidrojenin elektronegatifliği 2,2 değerine yakındır, diğer değerler ise biraz farklılık gösterir. Pauling, Mulliken ve Allred ve Rochow ölçeklerine göre hesaplanan element atomlarının elektronegatifliklerinin örnekleri aşağıdaki Tablo 2’de gösterilmektedir. Tablo 2 Pauling (P), Mulliken (M) ve Allred ve Rochow (AR) ölçeklerindeki örnek elemanların elektronegatiflikleri
Her ölçekte hidrojenin elektronegatifliği 2,2 değerine yakındır, diğer değerler ise biraz farklılık gösterir. Pauling, Mulliken ve Allred ve Rochow ölçeklerine göre hesaplanan element atomlarının elektronegatifliklerinin örnekleri aşağıdaki Tablo 2’de gösterilmektedir. Tablo 2 Pauling (P), Mulliken (M) ve Allred ve Rochow (AR) ölçeklerindeki örnek elemanların elektronegatiflikleri
| Atom | P | M | AR |
| F | 3.98 | 3.90 | 4.10 |
| Ö | 3.44 | 3.04 | 3.50 |
| N | 3.04 | 2.28 | 3.07 |
| Cl | 3.16 | 2.95 | 2.83 |
| C | 2.55 | 1.75 | 2.50 |
| H | 2.20 | 2.21 | 2.20 |
| Si | 1.90 | 2.25 | 1.74 |
| F | 0.82 | 0.77 | 0,91 |
| Rb | 0.82 | 0,50 | 0,89 |
| C’ler | 0,79 | – | 0.86 |
| Fr | 0.70 | – | 0.86 |
Üç yöntemle yapılan hesaplamalardaki farklılıklara rağmen, flor her ölçekte en yüksek elektronegatifliğe sahip olup onu oksijen, nitrojen ve klor takip etmektedir. En düşük değerler ise francium, sezyum, rubidyum ve potasyum için belirlendi. Tipik olarak metal olmayan elementlerin elektronegatifliği 2 değerinin üzerindedir, tipik metallerin elektronegatifliği ise 2’nin altındadır. Standart değer, yukarıda bahsedilen hidrojenin yaklaşık 2,2’lik elektronegatifliğidir. 
Periyodik tablodaki elektronegatiflik
Diğer birçok özellik gibi elektronegatiflik de kimyasal elementlerin periyodik tablodaki düzenine yansır. Grupta kabuk sayısı ve metalik karakter arttıkça elektronegatiflik azalır, dolayısıyla fransiyumdan hidrojene doğru artar. Zamanla, mevcut değerlik elektronlarının artması ve metalik olmayan karakterin (yani metallerden soy gazlara) azalmasıyla elektronegatiflik artar.
Elektronegatiflik ve bağ türü – özet
Kimyasal bağı oluşturan elementlerin elektronegatifliğinin bireysel değerlerini bilerek, onun doğasını çıkarabiliriz. Fark 0,0 ile 0,4 arasındaysa bağ kovalenttir. Fark 0,4 ile 1,7 arasında olduğunda bağ polarize kovalenttir. Elementlerin elektronegatifliğinde 1,7’nin üzerinde bir fark iyonik bağ olduğunu gösterir.
