Kimyada bazı kimyasal bileşikler su molekülleriyle özel bağlar oluşturur. Bunlar kimyasal bağlar değil, bu bileşiklerin özelliklerini spesifik olarak belirleyen kısa mesafeli etkileşimlerdir. Hidratlardan bahsediyoruz. Özellikleri seçilmiş endüstriyel sektörlerde kolaylıkla kullanılmaktadır. En popüler hidratlı tuz şüphesiz inşaat sektöründe önemli bir hammadde olan alçı taşı veya kalsiyum sülfat dihidrattır (VI). Hidratlar aynı zamanda nem içeriğinin de çok iyi göstergeleridir. Bu, susuz tuzun renginin genellikle hidratlı tuzun renginden farklı olmasıyla ilgilidir.

Hidratlar
Hidratlar , su molekülleri ile belirli bir tuzun molekülleri arasında kovalent bağlar gibi kimyasal bağların oluştuğu kimyasal bileşikler değildir. Ayrıca koordinasyon bileşikleri değildirler. Gücü kimyasal bağlardan çok daha zayıf olan hidrojen bağlarının oluşumu bu yapıların karakteristik özelliğidir. Hidratlar kristal kafes şeklinde yapılandırılmıştır. Su molekülleri düzensiz bir şekilde dağılmıştır. “Kristalleşme suyu” terimi sıklıkla kullanılır. Hidratlar hidrasyonla elde edilir. Tuz molekülleri, özellikle de inorganik asit türevleri büyük olasılıkla bu reaksiyona girer. Hidrasyon, susuz kristallerin hidratlı kristallere dönüşmesini içerir. Mineral kütlesinde değişikliğe neden olabilir ancak onu yok etmez. Hidrasyon genellikle karbonatlama gibi diğer işlemlere eşlik eder. Normal koşullar altında hidrasyon kimyasalları yüksek higroskopiklik , yani su moleküllerine karşı güçlü bir afinite ile karakterize edilir. Bu tür maddeler örneğin havadaki nemi emebilme özelliğine sahiptir. Hidrat elde etmenin bir başka yolu da onları sulu çözeltilerden kristalleştirmektir. Hidratların moleküler formülleri, tuz formülünün yazılması ve hidratlı su moleküllerinin sayısının belirtilmesiyle oluşturulur. Genel bir gösterim sağlamak amacıyla ‘n’ harfi ‘H 2 O’nun önüne yerleştirilir. Değerleri birden büyüktür ve bağlı olan su moleküllerinin sayısına karşılık gelir. En yaygın ayrımlar n=½ (hemihidrat), n= 1 (monohidrat), n=2 (dihidrat) ve n=3 (trihidrat) olan hidratlar arasındadır. Daha da önemlisi, aynı madde farklı sayıda su molekülünü bağlayabilir. ![]()
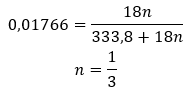 Tuz molekülleri ile su molekülleri arasında hidrojen bağları olduğu göz önüne alındığında bu bileşikler yüksek sıcaklıklara karşı tatmin edici bir direnç göstermezler. Isıtıldıklarında parçalanır ve susuz formlara dönüşürler. Hidratlar suda çok iyi çözünür. Sulu çözeltilerde tuza bağlı hidratlı su molekülleri açığa çıkar. Bu gerçek, örneğin bu maddelerin çözeltilerini hazırlarken dikkate alınmalıdır. Belirli bir bileşiğin hidrasyon derecesinin dikkate alınmaması, yalnızca çözeltinin konsantrasyonunun belirlenmesinde bile hatalara yol açar. Hidratlanmış tuzların önemli bir özelliği, hidrasyon reaksiyonunda su moleküllerinin bağlanması nedeniyle renklerinin değişmesidir . Hidratlı formların, susuz tuzlara kıyasla önemli ölçüde daha az higroskopisite gösterdiğine dikkat edilmelidir.
Tuz molekülleri ile su molekülleri arasında hidrojen bağları olduğu göz önüne alındığında bu bileşikler yüksek sıcaklıklara karşı tatmin edici bir direnç göstermezler. Isıtıldıklarında parçalanır ve susuz formlara dönüşürler. Hidratlar suda çok iyi çözünür. Sulu çözeltilerde tuza bağlı hidratlı su molekülleri açığa çıkar. Bu gerçek, örneğin bu maddelerin çözeltilerini hazırlarken dikkate alınmalıdır. Belirli bir bileşiğin hidrasyon derecesinin dikkate alınmaması, yalnızca çözeltinin konsantrasyonunun belirlenmesinde bile hatalara yol açar. Hidratlanmış tuzların önemli bir özelliği, hidrasyon reaksiyonunda su moleküllerinin bağlanması nedeniyle renklerinin değişmesidir . Hidratlı formların, susuz tuzlara kıyasla önemli ölçüde daha az higroskopisite gösterdiğine dikkat edilmelidir.
İnorganik bileşiklerin hidratları
İnorganik asitlerin tuzları , su molekülleriyle hidrat oluşturma olasılığı en yüksek olan maddelerdir. İnorganik bileşiklerin en yaygın hidratları şunları içerir:
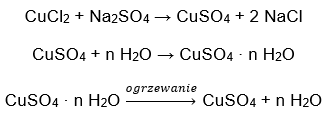
- Bakır (II) sülfat hidrat (VI), CuS04 – bakır (II) sülfat (VI), çeşitli derecelerde hidrasyonu benimser. Bağlanan maksimum su molekülü sayısı beştir. Bu tuzun pentahidratının ısıtılması sonucu su molekülleri ayrılır. İlk iki ve bir trihidrat oluşur ve sistemin daha fazla ısıtılmasıyla bakır (II) sülfat monohidrat (VI) elde edilebilir. Son su molekülünü çıkarmak için bileşiği 200 ᵒC’nin üzerinde bir sıcaklığa ısıtmak gerekir. Bakır (II) sülfat hidratlar (VI), bakır iyonlarının çevresinde kristalizasyon suyunun varlığından kaynaklanan mavi renktedir. Susuz tuz ise beyaz renktedir. Yüksek higroskopikliği ve hidrat oluşturma yeteneği, bazı sıvılardan nemi uzaklaştırmak için kullanılır.
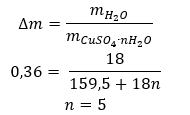
- Kobalt (II) klorür hidrat, CoCl2 – susuz kobalt (II) klorür oldukça higroskopiktir. Su moleküllerine olan güçlü ilgisi sayesinde havadaki nemi dahi emebilme özelliğine sahiptir. Bu işlem, bu tuzun hidratlarının oluşmasıyla sonuçlanır. En yaygın hidratlı form kobalt (II) klorür heksahidrattır – CoCl 2 * 6H2 Diğer bir form ise dihidrat molekülüdür. Bu tuz aynı zamanda nem içeriğine bağlı olarak renk değiştirme özelliği de göstermektedir. Susuz tuz mavidir, dihidrat pembemsi-mor bir renk alır ve hekzahidrat molekülünün rengi yoğun kırmızıdır.
- Sodyum sülfat hidrat ( VI ), Na2S04 – bu tuz iki hidrat formunda bulunur: heptahidrat (yapıda beş su molekülü) ve dekahidrat (yapıda on su molekülü). Sodyum sülfatın (VI) susuz formu doğada nadir bulunan tenardit minerali olarak bulunur. Sodyum sülfat on-hidrat (VI), Glauber tuzu olarak adlandırılır. Cam, kağıt, çamaşır deterjanı ve soda üretiminde yaygın olarak kullanılmaktadır. Glauber tuzu aynı zamanda mavi pigment ultramarinin üretimi için gerekli bileşenlerden biridir. Ayrıca bileşik, müshil özelliklerinden dolayı sindirim sistemi üzerinde tedavi edici bir etkiye sahiptir.

Alçı
Küresel öneme sahip ve geniş uygulama alanına sahip inorganik tuz hidratın bir örneği alçıdır. Kalsiyum sülfatın (VI) hidratlanmış formundan ve CaSO4’ten oluşan bir mineraldir. Kristalin alçı bu tuzun dihidratıdır. Doğal koşullar altında göl ve nehirlerdeki tuzlu suyun 42ᵒC’nin altındaki sıcaklıklarda buharlaşması sırasında oluşur. Susuz kalsiyum sülfat (VI) anhidrittir. Aynı zamanda susuz alçı olarak da adlandırılır. Yapı alçısı ise kalsiyum sülfat hemihidrattır (VI). Bu tuzun hangi formunun elde edileceği, ana tortul kayanın işlenmesi sırasında hakim olan sıcaklığa bağlıdır. İnşaatta kullanılan alçı genellikle farklı formlardaki hidratlı kireç tuzlarının bir karışımıdır. 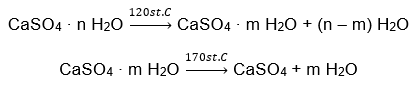
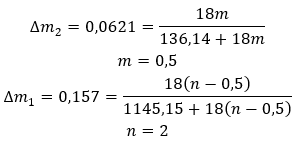 Alçının uygulama olanakları özellikle inşaat sektöründe çok geniştir. Bu tuz hidratın en önemli kullanım alanları aşağıda sıralanmıştır:
Alçının uygulama olanakları özellikle inşaat sektöründe çok geniştir. Bu tuz hidratın en önemli kullanım alanları aşağıda sıralanmıştır:
- İnşaat sektöründe kaplama elemanlarında alçı kullanılmaktadır. Gevşek yarı mamul ürünlerin, harçların, yapıştırıcıların, alçı esaslı kaplamaların ve alçıpan gibi hazır montaj bileşenlerinin bileşenlerinden biridir.
- Tıp, kırık uzuvları desteklemek için alçı kullanır. Alçı bandajlarının cilt dostu olduğu düşünülmektedir. Ayrıca malzeme diş teknolojisi laboratuvarlarında da kullanılmaktadır.
- Endüstri, modelleme ve tasarım atölyelerinde alçı kullanıyor. Alçı kalıpları çeşitli faydacı nesnelerin şekillendirilmesi için çok uygundur.
- Alçı, tarımda kullanılan bazı gübrelere katkı maddesidir.

Metan klatratlar
Metan klatratlar, gaz hidratlar olarak bilinen bir grup bileşiğe aittir. Dünya tarihindeki hızlı iklim değişikliğinin çoğundan onlar sorumludur. Metan klatratlara sıklıkla metan hidratlar veya metan buzu da denir. Su ve metanın katı bir formunu oluştururlar. Molekülleri kristal yapılarıyla ayırt edilir. Artan basınç altında oluşurlar. Dış görünüm açısından çoğu zaman buza benzeyen beyaz, kokusuz katılar şeklini alırlar. İlginç bir şekilde, dokunuşta polistirene benziyorlar. Klatratlar benzersiz kimyasal gruplardır . Su molekülleri kafese benzeyen bir yapı oluşturur. Metan bu kafesin içinde depolanıyor. Daha da önemlisi, iki madde birbiriyle kimyasal bağ oluşturmaz. Tipik olarak metan klatratlar iki küçük ve altı orta boy kafesi çevreleyen 46 su molekülünden oluşur. Metan molekülleri içlerinde sıkışıp kalır. Klatratların ayrıca içinde 16 küçük ve sekiz büyük metan gazı kafesi bulunan 136 su molekülünden oluştuğu da bilinmektedir. Son yıllarda okyanusların dibinde bu kaynağın önemli miktarları keşfedildi. Örneğin enerji amacıyla kullanılabilecek önemli miktarlarda metan çıkarma potansiyeli nedeniyle büyük ilgi görüyor. Metan klatratlar kırmızımsı renkte eşit bir alevle yanar. Yandıktan sonra erimiş su kalır. Bu şekilde elde edilen metan, geleneksel hidrokarbon kaynaklarına iyi bir alternatif olabilir ama aynı zamanda iklim için de büyük bir tehdit oluşturuyor. Okyanus tabanında biriken klatratlardan metanın çıkarılması konusunda hâlâ yeterli bilgi yok. Bu gazın önemli miktardaki kontrolsüz salınımı çok tehlikeli olabilir çünkü sera etkisini karbondioksitten çok daha güçlü bir şekilde artırır.
