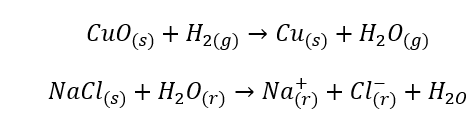Çeşitli fenomenler ve süreçler üzerindeki müzakereler çok katmanlı olmalıdır. Hem mikroskobik hem de makroskopik özellikleri dikkate almalıyız. Adından da anlaşılacağı gibi, bu bölme, analiz edilen maddelerin büyüklük sıralarına göre ayrılmasıyla yapılır. Kimyasal reaksiyonların termodinamiği ile yakından bağlantılı olan makroskobik alan, yoğunluk, sıcaklık veya çözünürlük gibi fiziksel ve kimyasal özellikleri gözlemlememizi ve ölçmemizi sağlar. Mikroskobik analiz ile moleküllerin hareketlerini ve etkileşimlerini gözlemleyebiliriz. Molekülleri hızları ve kinetik enerjileri ile tanımlayabiliriz. Bir karışımla ilgileniyorsak, onun homojenliğini ve dolayısıyla içinde bulunduğu sistemin türünü dikkate alabiliriz.

Fiziko-kimyasal sistemlerin sınıflandırılması
Malzeme sistemlerinin homojenliğini analiz ederken, makroskopik ölçek onları iki ana gruba ayırır: homojen ve heterojen sistemler. Bu kategorizasyon, fiziksel özelliklerine göre yapılır: farklı olabilen veya olmayan fiziksel durum, çözünürlük ve erime noktası. Her sistem, belirli bir reaksiyon veya süreçte yer alan tüm maddeleri içerir. Sistemin aynı özellikleri koruyarak açıkça öne çıkan kısmına faz denir. Üç farklı faz türü vardır: katı, sıvı ve gaz. Bunlar ile sistemin geri kalanı arasında bulunan yüzeye arayüz denir. Serbest entalpi (ΔG) veya entropiye (ΔS) bağlı olarak, ΔS>0 veya ΔG<0 ise, bir fazın diğerine dönüşümü otomatik olarak gerçekleşebilir.
Faz dengesi diyagramı
Farklı fazların varlığının grafik gösterimine faz denge diyagramı denir. Belirli fazların varlığını (belirli sıcaklık ve basınç aralıklarına ulaşılırsa) ve bunların karşılıklı dönüşümlerini içerir. Tek bileşenli bir sistem için şematik bir faz denge diyagramı, proses koşullarına bağlı olarak üç ana fazın varlığını gösterir. Gösterdiği çizgiler, ilgili iki faz arasındaki, yani katı ile gaz arasındaki, katı ile sıvı arasındaki ve gaz ile sıvı arasındaki denge durumlarını gösterir. Böylece kritik parametrelerden birini bilirsek, söz konusu bileşenin erimesine, donmasına, buharlaşmasına, yoğunlaşmasına, süblimleşmesine veya yeniden süblimleşmesine neden olacak koşulları belirleyebiliriz. Ek olarak, şema, tüm faz çizgilerinin birleştiği üçlü bir nokta içerir; bu, üç fazın hepsinin belirli koşullarda bir arada bulunabileceğini gösterir. Diyagram ayrıca iki önemli nokta içerir: kritik basınç ve kritik sıcaklık. Kritik basınç, bir sıvıyı gaza dönüştürebileceğimiz maksimum basıncı veya sıvının üzerindeki doymuş buharın olası maksimum basıncını temsil eden nokta ile gösterilir. Kritik sıcaklık kavramı, basınç arttıkça bir gazın yoğunlaşabileceği en yüksek sıcaklığı tanımlar. Bu nedenle, kritik sıcaklık ve kritik basınç koşullarında bulunan kritik nokta, sıvı ve gaz fazlarının ayırt edilmesinin imkansız olduğu bir durumu tanımlar.
Gibbs faz kuralı
Termodinamik dengede bulunan herhangi bir sisteme uygulanabilen özel bir ilişkidir. Bu kuralı temsil eden denklem, bağımsız bileşenlerin sayısı (n) ve serbestlik derecesi sayısı (s) ile birlikte sistemde bulunan faz sayısını (f) içerir. s sayısı, değiştirilirse izole edilmiş sistemin dengesindeki faz sayısını bozmayacak olan ayarlanabilir yoğun değişkenlerin miktarına karşılık gelir. Yoğun değişkenler, hiçbir şekilde sisteme (örneğin, geometrik boyutlar veya hacim) veya molekül sayısına, ağırlığına, özgül ısısına vb. bağlı olmayan herhangi bir fiziksel değerdir. Denklem aşağıdaki gibidir: Sistemin bağımsız bileşenleri n olarak belirtilen, herhangi bir miktarda fazlarının her birini inşa etmek için gerekli olan en düşük sistem bileşeni sayısını pratik olarak temsil eder. Bileşenleri birbiriyle reaksiyona girebilen bir sistemi analiz edersek, n değerini, sistemi oluşturan bileşenlerin toplam sayısından bağımsız reaksiyon denklemlerinin sayısını çıkararak hesaplarız. Böylece, aşağıdaki gösterimi varsayarsak: ![]() bağımsız denklemlerin sayısı 1’dir – sistemde meydana gelen belirli bir reaksiyonu inceliyoruz. Bağımsız bir denklem, diğerlerini birleştirerek herhangi birinin elde edilmesinin imkansız olduğu herhangi bir kimyasal denklem sistemidir. Oysa böyle bir sistem için bileşen sayısı 3’tür: bunlar CaCO 3 , CaO ve CO 2’dir . Bu bilgi ayrıca bağımsız bileşenlerin sayısını hesaplamamızı sağlar: n = bileşen sayısı – bağımsız denklem sayısı ve böylece: n = 3 – 1 = 2 Aynı örneği serbestlik derecesi sayısını hesaplamak için kullanabiliriz Gibbs faz kuralı için denklemi kullanarak: s = n – f + 2 = 2 – 3 + 2 = 1 Bu değer, sistem dengesinde sabit bir faz miktarını korumak için yalnızca bir yoğun değişken çalıştırabileceğimizi gösterir.
bağımsız denklemlerin sayısı 1’dir – sistemde meydana gelen belirli bir reaksiyonu inceliyoruz. Bağımsız bir denklem, diğerlerini birleştirerek herhangi birinin elde edilmesinin imkansız olduğu herhangi bir kimyasal denklem sistemidir. Oysa böyle bir sistem için bileşen sayısı 3’tür: bunlar CaCO 3 , CaO ve CO 2’dir . Bu bilgi ayrıca bağımsız bileşenlerin sayısını hesaplamamızı sağlar: n = bileşen sayısı – bağımsız denklem sayısı ve böylece: n = 3 – 1 = 2 Aynı örneği serbestlik derecesi sayısını hesaplamak için kullanabiliriz Gibbs faz kuralı için denklemi kullanarak: s = n – f + 2 = 2 – 3 + 2 = 1 Bu değer, sistem dengesinde sabit bir faz miktarını korumak için yalnızca bir yoğun değişken çalıştırabileceğimizi gösterir. 
heterojen sistemler
Birden fazla faz içeren herhangi bir sistem (yani homojen olmayan bir sistem) aynı zamanda heterojendir. Aşamaların türü önemsizdir; heterojen bir sistem aynı anda birkaç katı ve sıvı faz içerebilir, ancak yalnızca bir gaz fazı içerebilir. Bu, gazların mükemmel bir şekilde karışmasından kaynaklanmaktadır. Heterojen bir sistemin ilginç bir örneği granittir – kuvars, potasyum feldspat, plajiyoklaz ve biyotit dahil olmak üzere birçok katı faz içerir. Pek çok gıda ürünü aynı zamanda heterojen olarak da adlandırılabilir, mükemmel örnekler yağ, baharat ve diğer katkı maddelerinden oluşan çok bileşenli müsli veya salata soslarıdır. Homojen olmayan karışımların ilginç bir türü kolloidlerdir (bileşenleri yalnızca mikroskopla ayırt edilebilen çözeltiler). Ancak çoğu durumda basit yöntemler veya araçlarla ayrılabilirler. Örneğin, su ve yağdan oluşan bir karışımı ayırmak için boşaltmayı kullanabiliriz – içerikler çıplak gözle görülebilir. Homojen olmayan karışımları etkili bir şekilde ayırmak için kullanabileceğimiz diğer yöntemler şunları içerir: filtrasyon, mekanik ayırma veya santrifüjleme. Özellikleri farklı olan bir mineral karışımı için benzerdir: kuvars, mika ve feldispat bir çekiçle bile ayrılabilir.
homojen sistemler
Heterojen sistemlerden farklı olarak, homojen bir sistem sadece bir fazın varlığı ile karakterize edilir. Böyle bir durumda bileşenleri çıplak gözle ayırt edemeyiz. Basit ayırma yöntemleri de etkisizdir ve yalnızca fiziksel özelliklere dayalı yöntemler faydalı olabilir. Böyle bir yöntemin bir örneği, belirli bir sistemin çeşitlendirilmiş kaynama noktalarına dayanan damıtma yoluyla ayırmadır. Homojen karışımları ayırmada etkili olan diğer yöntemler kristalleştirme ve kromatografidir. Özel bir homojen sistem türü, tek fazı yalnızca bir bileşen içeren saf bir maddedir. Başka bir örnek, her tür homojen çözelti ve karışımdır – yalnızca bir fazın varlığına rağmen, sistem birçok bileşen içerebilir. Sistemde bulunan faz sıvı, katı veya gaz olabileceği gibi çözeltiler de bu şekilde olabilir. Bu tür sistemlere örnek olarak sıvı karışımlar (sirke, su), gaz karışımları (atmosferik hava) ve mineral cevherleri ve bronz veya pirinç gibi her tür alaşım dahil katı karışımlar verilebilir.
Sistemlerdeki geçişler
Sistemlerde iki tür geçiş meydana gelebilir, bunlar faz (bazen fiziksel olarak adlandırılır) ve kimyasal geçişlerdir. Öncekiler, yeni kimyasal maddeler üretmeyen tüm geçişleri içerir. Halihazırda mevcut olan bileşenlerin solmasıyla da karakterize edilmezler. Ancak adından da anlaşılacağı gibi yapı veya fiziksel durumda bu tür değişikliklere yol açarlar.. Orijinal faz solup giderken yeni bir faz oluşması da mümkündür. Faz geçişlerinin örnekleri, öğelerin yeniden süblimleşmesini ve polimorfik geçişlerini içerir. Kimyasal geçişler tamamen farklı bir mekanizma gösterir. Bunlar, orijinal bileşenlerin yerini alan yeni maddeler üreten reaksiyonlardır. Bu tür geçişler, örneğin bir veya daha fazla fazda hidroliz sırasında ve yanma sırasında olmak üzere iki varyantta gerçekleştirilebilir.
Kimyasal reaksiyonlar
- Homojen reaksiyonlar, substratlar ve ürünler dahil olmak üzere tüm sistem tek fazda olduğunda meydana gelir, örneğin:
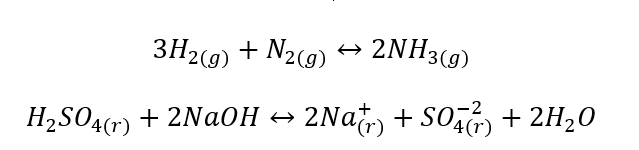
- Heterojen reaksiyonlar, substratlar ve ürünler de dahil olmak üzere sistemin en az iki farklı fazda olduğu reaksiyonlardır. Bu tür reaksiyonlar her zaman arayüzde gerçekleşir, örneğin: