"Element" terimi, çekirdekleri belirli sayıda proton içeren atomları ifade eder. Dışlarında bir atom bulunan başka parçalardan de oluşur: nötronlar. Tek bir elemanın barındırdığı sınırlar. Böyle bir durumda, izotoplardan, yani belirli bir elementin yapılarında farklı sayıda nötron bulunan gözlemlerinden oluşuyoruz. dolayısıyla kütle miktarları da farklıdır. Bununla birlikte, elektron kabuklarındaki sayısı elektron değişmeden kalması için atom numarası sabit kalır.

Bu nedenle aynı elementin izotopları tablosunda aynı konuşmaya sahiptir ve her birinin boyutu aynıdır. Ayrıca kimyasal ve canlı özellikleri de benzerdir. Bununla birlikte, özellikle özelliklerin daha çeşitli olduğu istisnalar vardır, bu genellikle kütle değerlerinin önemli değişkenlerine sahip iki izotopla uğraştığımızda ortaya çıkarır. Bunun nedeni, yapılandırma veya bölümlerin difüzyon hızı gibi bir dizi özelliğinin bileşenlerinden oluşması. Buna karşılık, iletkenlik veya renk gibi kütleye bağlı değildir. Kimyasal özelliklerin davranışları gereğince çeşitli izotopların eşit olmayan hızlarından geçen.
Nüklitler ve izotoplar
Daha genel olan izotoplarla ilgili bir kavram var. Bir nüklid, nükleer yapı özellikle proton ve nötron sayılarıyla belirlenmiş bütün bir atom setidir. Bu, nötronun dikkate alınmasını gösteren iki öğenin izotop olabileceğini anlamlandırır. Uygulamada, tüm izotoplar nüklidlerdir, ancak her nüklid mutlaka bir izotop değildir. Bu iki konseptten oluşan ana fikir, izotoplar söz konusu olduğunda kimyasal özellikler ve nüklidler söz konusu olduğunda nükleer özellikleri kapsar. örneğin:
- İzotop olan nüklidler:
- İzotop olmayan nüklidler:
Doğadaki izotoplar
Doğal etkilerde bulunan kimyasal elementler, sabit bir yüzde gruplara sahip izotopların bir karışımıdır. Çekirdeğe bağlı olarak, bir element bir, birkaç veya daha fazla izotopun yanından geçer. bazı taraflardır, ancak bazıları hızla dönüşür. Böyle bir ayrışma, aynı veya farklı bir elementin izotoplarını üretebilir. Bu tür geçişler genellikle radyasyon emisyonu ile birlikte gider. Programı bir değer kullanmak gerekirse, Dünya’da atom numaraları 92’ye eşit veya daha küçük olan elementler vardır. 83’e kadar olanlar kararı kabul edilir. Kararlı izotoplara sahip, doğal olarak var olan 81 kadar eleman vardır. Bunlar arasında 28 Si, 29 Si ve 30 Si izotoplu silikon, 54 Fe, 56 Fe, 57 Fe ve 58 Fe izotoplu demir veya yalnızca bir tanesi izotop: 27 Al olan alüminyum bulunur.
Pazarlama izotopları
Doğada, bir element karışımından oluşan üç çocuğu izotopu sahibiniz. Pratikte, 1H (hidrojen- 1 ) ve 2H (hidrojen-2) izotopları, toplam koruma evlerinin sırasıyla %99.985 ve %0.015’inin açıklamasını yapar. İzotop 3H (hidrojen- 3 ) kararsızdır ve yalnızca bazı eser miktarları temsil eder. Hidrojen-1 en iyi bilinen protiumdur, Savaş-2 (döteryum da denir) bir proton ve bir nötrondan oluşurken, son izotopun (hidrojen-3 yani trityum) içinde bir proton ve iki nötron içerir. Bu nedenle, bu izotoplar arasındaki kütle farkı önemlidir: döteryumun atomu, protiyumunkinden iki kat daha ağırken, trityum, protyumdan bile üç kat daha ağırdır. Bildiğimiz gibi, herhangi bir izotopik formdaki Savaş iki atomlu bir grup olarak bulunur. HD (protium-döteryum), HT (protium-tritium) ve DT (döteryum-trityum) gibi farklı izotoplar içeren birimler de oluşturabileceği ortaya çıktı. Döteryum, radyo olmayan aktif, yüksek düşüncelerde bir izotoptur. Bazen ağır savaş olarak adlandırılır. Bir su birliğinde (D 2 O ) Savaş-1’i döteryum ile seçimlersek, bölümlerin özellikleri arasında: erime noktası yaklaşık 1,5 o C yükselir ve donma noktası 3,81 o C’ye kadar düşer. Yoğunluğu da H 2 O’ya göre yaklaşık %0,1 oranında artacaktır. Buna karşılık, trityum, aynı zamanda radyoaktif olan oldukça kararsız bir izotoptur. Çekirdeği, helyum atomlarının ürettiği radyoaktif ayrışmaların olduğu bir yer. İzotopların fizikokimyasal özelliklerini karşılaştırırsak, Tablo 1’de belirtilen temel detayları buluruz. Tablo 1. Hidrojen izotoplarının temel fiziko-kimyasal özelliklerinin karşılaştırılması.
| İzotop | sembol | Yoğunluk [g /l] | Erime noktası [K] | Kaynama noktası [K] |
| Protium | H | 0,08233 | 13.83 | 20.27 |
| Döteryum | D | 0,1645 | 18.73 | 23.67 |
| trityum | T | 0,2464 | 20.62 | 25.04 |
karbon izotopları
Karbonun bilinen üç izotopu vardır : her biri aynı kimyasal ışığa sahip olan 12C, 13C ve 14C . En yaygın olanı, tüm atomların %98.89’unu temsil eden karbon-12’dir. Dünya’da bulunan 13 C izotopu yaklaşık %1.11’i temsil ederken, 14 C atomu yaklaşık 1012’de bir oluşur. İkincisi, beta radyasyonunun çoğalmasına neden olanların sayısı ayrışmaya eğilimlidir. Daha sonra izotop bir nitrojen atomuna dönüşür. Kararlı bir izotop karbon-13’tür. Sıfır olmayan dönüş sayesinde 13 NMR nükleer manyetik rezonansta uygulanabilir.
izotopların ömür boyu
Duman dedektörlerinde, radyasyon emisyonu ile birlikte yavaş ayrışma ile alıcılardan gelen kararsız izotoplar, 241 Am veya 238 Pu gider. Duman saldırılarında, radyasyon bloke edilir ve artık dedektöre ulaşmaz, böylece alarm tetiklenir. Bazı elementlerin ayrışma radyasyonu mikroorganizmaları yok edebilir ve bu nedenle 60 Co dahil olmak üzere izotoplar gıdaları korumak için kullanılabilir. Tıbbi teşhiste, test edilen organlardaki, numunelerdeki muayenelerdeki veya kalpteki galaksideki tespit etmek için belirli çekirdekler kullanılır. Böyle bir izotop, bulma yolu olarak bilinen biyolojik olarak aktif olmayan bir madde ile birleşerek onu kan zinciri sokar. Bu, radyasyonun izlenme yolu izlemeyi ve doku ve organlarda biricikçe gözlemlemeyi mümkün kılabilir. Tümör tedavileri ayrıca 226 Ra ve 60 Co gibi kararsız izotopların radyasyon yaymasına dayalı radyoterapi uyguluyoruz. Böyle bir hücreleri amaçlanan tümör hücrelerini yok etmek. Karbon izotoplarından biri olan 14 C, organik kökenli malzemelerin yaşını tayin etmek için uygulanır. Bu kararsız çekirdekler yavaş yavaş ayrışır ve organizmalar ölürse (ki bu karbon asimilasyon durur), karbon-14 geçen yıllar ile grup olarak azalır. Bazı izotoplar, örnek 239 Pu ve 235 U, nükleer santrallerde kullanılmaktadır. Bu kararsız çekirdeklerin ayrışması sırasında, elektriğe dönüştürülebilen enerji üretilir.
Atom kütlesi ve izotoplar
Periyodik tablolardaki elementlerin atomik kütlesi aslında ortalama kütledir. Hesaplarken, aşağıdaki formüle göre, söz konusu unsurun her bir izotopunun yerine getirilmesi (n) ve yüzde gruplarını (x n ) dikkate alırız: 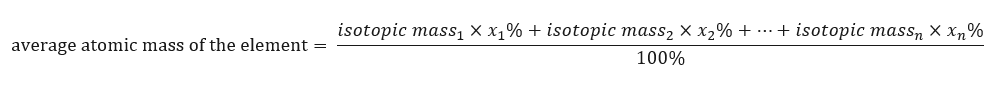 Örneğin, eğitimin ortalama atom kütlesini hesaplarken aşağıdaki hesaplamaları elde ederiz:
Örneğin, eğitimin ortalama atom kütlesini hesaplarken aşağıdaki hesaplamaları elde ederiz: 
