Yapılarına bakıldığında karboksilik asitler önemli organik bileşiklerdir ve asil türevleridir. Esterler ve amidler dahil olmak üzere birçok türev için bir tür yapı malzemesidirler. Doğada, sofra sirkesinin temel bileşiği olan asetik asit CH3COOH , ekşimiş tereyağı kokusundan sorumlu butirik asit CH3CH2CH2COOH veya daha fazlası gibi çok çeşitli karboksilik asitler bulabiliriz. insan safra sularının temel bileşeni olan kompleks kolik asit.

Karboksilik asitlerin genel formülü şöyledir:
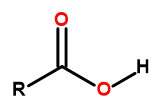
Şekil1 Karboksilik asitlerin genel formülü şöyledir:
Karboksilik asitlerin adlandırılması
IUPAC terminoloji sistemine göre, karboksilik asitler, molekülün boyutuna ve karmaşıklığına bağlı olarak iki şekilde adlandırılabilir. Alifatik türevler olan asitler, sistematik olarak alkan sonunun -an’dan -oik’e değiştirilmesi ve baştaki "asit" kelimesinin eklenmesiyle adlandırılır, örneğin propanoik asit, bütanoik asit, 3-etil-6-metiloktandioik asit. Bu tür kimyasal bileşiklerdeki karbon atomlarının numaralandırılması her zaman -COOH fonksiyonel grubundaki atomla başlar. Özellikle halkaya karboksil grubunun bağlı olduğu asitler için yararlı olan ikinci adlandırma sisteminin, bileşiğin sistematik adına kendisinden önce "asit" ve sonra "karboksilik" sözcüklerini eklemesine izin verilir. Bu gibi durumlarda, karbon atomlarının numaralandırılması, kendisi bir sübstitüent olarak ele alınan karboksil grubunun bağlı olduğu atomla başlar.
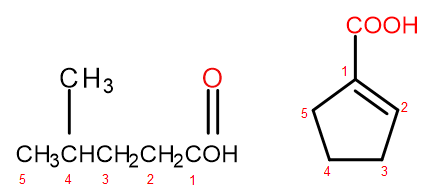
Şekil 2 Soldan sağa karbon atomlarının numaralandırılması: 4-metilpentanoik asit, 1-siklopentenkarboksilik asit.
| Karboksilik asit | asil grubu | ||
| Yapı | İsim | Yapı | İsim |
| HCOOH | Formik | HCO- | formil- |
| CH3COOH | Asetik | CH3CO- | asetil- |
| CH3CH2CH2COOH _ _ | bütirik | CH3CH2CH2CO- _ _ | bütiril- |
| HOOOCCOOH | Oksalik | -OCCO- | oksalil- |
| HOOC(CH 2 ) 2 COOH | süksinik | -OC(CH 2 ) 2 CO- | süksinil- |
Karboksilik asitlerin yapısı ve fiziksel özellikleri
Karboksil grubunun hem ketonlara hem de alkollere benzerliği, benzer fiziksel özellikler gösterebilir. Ketonlarda olduğu gibi, fonksiyonel grubun karbon atomu bir sp2 hibritleşmesine sahiptir . Bu, düz yapısı ve CCO ile OCO bağları arasındaki yaklaşık 120 o’lik açılarla doğrudan ilişkilidir. Örneğin, asetik asit CH3COOH aşağıdakilere eşit bağ açılarına sahiptir:
- CC=O için 119 o ,
- CC-OH için 119 o ,
- O=C-OH için 122 o .
Bağ uzunlukları aşağıdaki gibidir:
- CC için 52Å,
- C=O için 25Å,
- C-OH için 31Å.
Karboksilik asitler, hidrojen bağları oluşturma olasılığından kaynaklanan güçlü çağrışımsallıkları nedeniyle alkollere benzerlik gösterirler. Uygulamada, bu bileşiklerin çoğu, yapısı hidrojen bağlarının oluşumuyla korunan siklik dimerler olarak bulunur. Böyle spesifik bir hidrojen bağı sistemi, karboksilik asitlerin kaynama noktalarını da etkiler. Karşılık gelen alkollere kıyasla önemli artışlarına neden olur. Örneğin, fiziksel sabitler – sırasıyla erime noktası ve kaynama noktası Santigrat derece cinsinden:
- Formik asit : 8.4; 100.7,
- Asetik asit: 16.6; 117.9,
- Propanoik asit: -20.8; 141,
- Benzoik asit: 122.1; 249.
Karboksilik asitlerin ayrışması
Bu bileşik grubunun asidik özellikleri, sodyum hidroksit ve potasyum bikarbonat dahil olmak üzere bazlarla reaksiyona girmelerini mümkün kılar. Bu tür reaksiyonların ürünleri, karboksilik asitlerin tuzlarıdır. Karboksilik asitlerin sudaki çözünürlüğü ihmal edilebilir düzeydedir, ancak alkali metallerle olan tuzları iyonik yapılarından dolayı suda çok iyi çözünürler. Bronsted-Lowry teorisinde asit olan bu bileşikler seyreltik sulu çözeltilerde ayrışırlar. Dönüşümün bir sonucu olarak karboksilat anyonu RCOO – ve hidronyum katyonu H3O + oluşur.
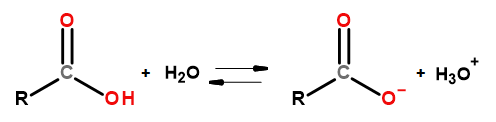
Şekil 3Karboksilik asit ayrışma şeması.
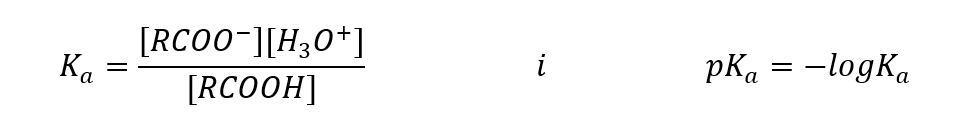 Karboksilik asitler için ampirik olarak belirlenen değerler, bunların zayıf ayrışmış bileşikler olduğunu gösterir, bu nedenle pratikte aynı zamanda zayıf asitlerdir. Çoğu için K a sabiti yaklaşık 10-5 değerini alır. Asetik asit Ka = 1.76.10-5 için , dönüşümden sonra pKa’ya 4.75’e eşit bir değer verir. Bu, moleküllerin yalnızca yaklaşık %0,1’inin ayrışmasına eşittir; bu, %100 ayrışma derecesine sahip güçlü inorganik asitlerle karşılaştırıldığında, bunların düşük mukavemetli asitler olduğunu doğrular. Denge sabitleri 10-16 büyüklük sırasına göre salınan alkollerle karşılaştırıldığında, karboksilik asitler çok daha güçlüdür. Yapısal benzerliklerine rağmen, bu gerçek, karboksilat anyonunun alkoksit anyonuna göre kararlılığından kaynaklanmaktadır. Alkoksitlerdeki negatif yükün, oldukça elektronegatif olan tek bir oksijen atomunda olduğuna dikkat edin. Buna karşılık, karboksilat anyonlarında yük, fonksiyonel grubun iki oksijeni arasında delokalize edilir. Bu, alkoller tarafından üretilen anyona kıyasla daha kararlı hale getirir.
Karboksilik asitler için ampirik olarak belirlenen değerler, bunların zayıf ayrışmış bileşikler olduğunu gösterir, bu nedenle pratikte aynı zamanda zayıf asitlerdir. Çoğu için K a sabiti yaklaşık 10-5 değerini alır. Asetik asit Ka = 1.76.10-5 için , dönüşümden sonra pKa’ya 4.75’e eşit bir değer verir. Bu, moleküllerin yalnızca yaklaşık %0,1’inin ayrışmasına eşittir; bu, %100 ayrışma derecesine sahip güçlü inorganik asitlerle karşılaştırıldığında, bunların düşük mukavemetli asitler olduğunu doğrular. Denge sabitleri 10-16 büyüklük sırasına göre salınan alkollerle karşılaştırıldığında, karboksilik asitler çok daha güçlüdür. Yapısal benzerliklerine rağmen, bu gerçek, karboksilat anyonunun alkoksit anyonuna göre kararlılığından kaynaklanmaktadır. Alkoksitlerdeki negatif yükün, oldukça elektronegatif olan tek bir oksijen atomunda olduğuna dikkat edin. Buna karşılık, karboksilat anyonlarında yük, fonksiyonel grubun iki oksijeni arasında delokalize edilir. Bu, alkoller tarafından üretilen anyona kıyasla daha kararlı hale getirir.
Karboksilik asitlerin elde edilmesi
- İkame edilmiş alkilbenzenlerin KMn04 veya Na2Cr207 ile sübstitüe edilmiş benzoik asitler formundaki ürün ile oksidasyonu. Birincil ve ikincil alkil gruplarını oksitlemek mümkündür,
- Alkenlerdeki C=C bağının en az bir vinil hidrojen atomu ile KMnO4 kullanılarak oksidasyonu,
- Birincil alkollerin ve aldehitlerin oksidasyonu. Jones reaktifi kullanan alkoller, aynı reaktif ve bazik gümüş oksit kullanan aldehitler,
- Nitrillerin güçlü, sıcak asit veya baz çözeltilerinin etkisi altında hidrolizi,
- Grignard bileşiklerinin magnezyum karboksilat formundaki bir ara ürünle karbondioksit ile reaksiyonu. Geçiş bileşiği daha sonra asitle reaksiyona girer.
Karboksilik asitlerin reaksiyonları
Karboksilik asitler yapıları gereği karakteristik reaksiyonlarının yanı sıra alkol ve ketonlara benzer dönüşümlere de uğrarlar. Alkoller gibi, bir nükleofilik reaktif oluşturmak için bir protonu ayırabilirler. Ketonlar gibi, karbonil grubunun karbon atomuna diğer nükleofillerin saldırısına maruz kalırlar. Ayrıca bunların indirgenmesi, alfa konumunda yer değiştirmesi, asil grubunun nükleofilik yer değiştirmesi ve deprotonasyon (ayrışma) mümkündür. Karboksilik asitlerin indirgenmesi LiAlH4 ile gerçekleşir ve ürünü birincil alkol olarak verir. Bazen verimliliği artırmak için bir tetrahidrofuran çözeltisinde ısıtma uygulamak gerekir. Diğer bir yöntem, tetrahidrofuran çözeltisi içinde boran kullanılarak, yine alkoller elde edilerek bir indirgemedir.
