Tanım olarak kimyasal aktivite, bir elementin kimyasal reaksiyonlarda elektron verme yeteneğidir. Pratikte aktiviteleri, bir elementin elektronları çekme yeteneğinin bir ölçüsü olan elektronegatifliğin azalmasıyla birlikte artar. Bir metal elektronları güçlü bir şekilde çekmiyorsa daha reaktiftir. Metallerin kimyasal aktivitesini sınıflandırmak için bir referans element olan hidrojen kullanılır. Bir metalin aktivitesinin bir ölçüsü, hidrojeni asitlerden veya hidrojeni bir su molekülünden çıkarma yeteneğidir.

Metallerin kimyasal aktivite serisi
Bu terim, doğası gereği metalik olan kimyasal elementlerin, kimyasal olarak en az aktiften en çok aktif olana kadar belirli bir sırayla özetini tanımlamak için kullanılır. Bu, farklı metallerin aktivitesini karşılaştırmak için kullanılır. Kimyasal aktivite serisi, metallerin yanı sıra referans element olan metal olmayan bir hidrojeni de içerir. Bir metal aktivite serisinde ne kadar yüksekse, o kadar reaktiftir . Aynı zamanda daha kolay oksitlenmesi ve dolayısıyla daha güçlü bir indirgeyici ve kimyasal olarak daha aktif bir element olmasıyla da ilgilidir. Bunun tersine, bir metal aktivite serisinde ne kadar alt sıralara yerleştirilirse, o kadar az reaktif olur. Bu, indirgeme reaksiyonuna daha kolay girdiği ve bu nedenle daha güçlü bir oksidan, daha az aktif bir element olduğu anlamına gelir. Tablo 1’de gösterilen değerleri kullanarak, bir elementin standart potansiyelinin değeri ne kadar düşükse, indirgeyicinin o kadar güçlü olduğunu ve metalin kimyasal olarak daha reaktif olduğunu görebiliriz. Bir dizi metal aktivitesinde elektron bağışlama yeteneğinin bir ölçüsü bunların standart potansiyel değeridir . Hidrojen veya daha doğrusu hidrojen elektrodu için standart potansiyelin sıfır olduğu varsayılır. Standart potansiyel, standart bir hidrojen yarı hücresinden ve substratların ve ürünlerin konsantrasyonlarının 1 mol/ dm3 olduğu diğer yarı hücreden oluşan bir hücrenin elektromotor kuvvetidir.
| Elektrot | Standart potansiyel [V] |
| Li/Li + | -3.04 |
| Ca/Ca 2+ | -2.86 |
| Mg/Mg 3+ | -2.36 |
| Al/Al 3+ | -1.69 |
| Min/Mn 2+ | -1.18 |
| Zn/Zn 2+ | -0.76 |
| Cr/Cr3 + | -0,74 |
| Fe/Fe 2+ | -0,44 |
| Cd/Cd 2+ | -0.40 |
| Co/Co 2+ | -0,28 |
| Ni/Ni 2+ | -0,26 |
| Sn/Sn 2+ | -0,14 |
| Pb/Pb 2+ | -0,14 |
| Fe/Fe 3+ | 0,04 |
| H2 /2H + | 0,00 |
| Bi/Bi 3+ | +0,32 |
| Cu/Cu 2+ | +0,34 |
| Ag/Ag + | +0,80 |
| Hg/Hg 2+ | +0,85 |
| Au/Au 3+ | +1,52 |
Tablo 1 . Elektrokimyasal metal serisi Serinin en üstünde görünen metaller en aktif olanlardır. Hidrojenin üstündekiler kolayca oksitlenme eğilimindedir ve bu nedenle hidrojenden daha güçlü indirgeyici maddelerdir. Serideki hidrojenin altındaki elementler daha kolay indirgenir ve daha güçlü oksitleyicilerdir. Bir metal diğerine göre daha negatif potansiyele sahipse bu, onu tuzundan uzaklaştıracağı anlamına gelir. Örneğin demir, bakır tuzlarında bakırın yerini alacaktır, ancak bakır, demirin tuzlarını değiştirmeyecektir. Bunun yerine gümüşü gümüş tuzlarından uzaklaştırabilir. Diğer metallerin tuzlarının çözeltilerinden elde edilen lityum ve berilyum bunların yerini almaz, ancak doğrudan suyla reaksiyona girer. Hidrojenin yerini alırlar ve bileşiklerini – hidroksitleri – üretirler. Bu tür metallere aktif metaller denir. Metal aktivitesi ve elementlerin periyodik tablosu Diğer birçok özellik gibi, bir elementin kimyasal aktivitesi de periyodik tablodaki konumundan çıkarılabilir. En aktif metaller, hidrojeni sudan kolayca hidroksitler oluşturacak şekilde uzaklaştırdıkları için grup I ve II’deki metallerdir. Grupta metallerin kimyasal aktivitesi atom numarasının artmasıyla artar. Atom numarası arttıkça periyot azalır. 
Değerli ve baz metaller
Hidrojen sadece bir aktivite referans noktası sağlamakla kalmaz, aynı zamanda serideki değerli ve baz metalleri de ayırır . Baz metaller hidrojenin üstünde olanlardır. Her biri asitlerle reaksiyona girerek hidrojeni onlardan uzaklaştırır. Potasyumdan kalsiyuma kadar oda sıcaklığındaki suyla reaksiyona girerler ve magnezyumdan demire kadar yüksek sıcaklıklarda reaksiyona girerler. Aktivite serisinde hidrojenin altında bulunan tüm metaller , asitlerdeki hidrojenin yerini almaz . Bununla birlikte, asit kalıntısının indirgenmesiyle oluşan ilgili tuzları ve oksitleri oluşturmak için oksitleyici asitlerle reaksiyona girebilirler. Serinin alt kısmında yer alan gümüşten altına kadar elementler kimyasal reaksiyonlara karşı o kadar dayanıklıdır ki yalnızca kral suyuyla reaksiyona girerler . Böyle bir çözelti, 3:1 hacim oranında karıştırılmış, konsantre bir hidroklorik asit çözeltisi ile konsantre bir nitrik asit (V) çözeltisinin bir karışımıdır . Bu gerçekleri bilerek, elementin aktivitesini ayırt etmek için çeşitli reaksiyonların gerçekleştirilebileceği sonucuna varabiliriz: oda sıcaklığında su ile, sıcak su ile, oksitleyici olmayan asit ile, oksitleyici asit ile ve kral suyu ile.
Asitlerden hidrojenin yerini alan metalleri tespit etmek için deney yapın
Metal aktivitesini doğrulamanın en kolay yolu bir deney yapmaktır. Bunu yapmak için, aşağıdakilerin art arda yerleştirileceği on test tüpü hazırlanmalıdır: 1-5’te: magnezyum şerit, çinko tel, demir tel, nikel tel ve bakır tel. Aynı sıra 6-10 numaralı tüplerde de tekrarlanmalıdır. 1-5 numaralı tüplere birkaç mililitre hidroklorik asit ve 6-10 numaralı tüplere birkaç mililitre seyreltik sülfürik asit (VI) ekleyin. Her tüpe yanma ateli uygulayın. Asitlerle dolu, magnezyum şeritler ve demir, çinko ve nikel teller içeren test tüplerinde gaz kabarcıkları yayılır. En yoğun salınım magnezyum içeren tüplerde gözlemlenebilir. Meydana gelen reaksiyonlar şu şekildedir: 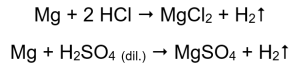 Yayılan gaz miktarı seri olarak azalır: çinko, demir, nikel. Buna göre aşağıdaki reaksiyonlar gerçekleşir:
Yayılan gaz miktarı seri olarak azalır: çinko, demir, nikel. Buna göre aşağıdaki reaksiyonlar gerçekleşir:  İçinde bakır tel bulunan tüplerde gaz görülmez, değişiklik olmaz. Bu, bu tür reaksiyonların meydana gelmediği anlamına gelir:
İçinde bakır tel bulunan tüplerde gaz görülmez, değişiklik olmaz. Bu, bu tür reaksiyonların meydana gelmediği anlamına gelir: 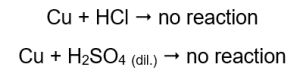 Yanan atel uygulandığında gazın çıktığı tüplerde belirgin bir ses duyulur.
Yanan atel uygulandığında gazın çıktığı tüplerde belirgin bir ses duyulur.
Gözlemlerin ve sonuçların özeti:
Magnezyum, çinko, demir ve nikel hem hidroklorik asit hem de sülfürik asit (VI) ile reaksiyona girer. Her biri hidrojeni asitten uzaklaştırır, bu da onların metal aktivite serisinde asitten daha yüksek olduğu anlamına gelir. Reaksiyonlar, tuzlar ve açığa çıkan hidrojen gazı formunda ürünler üretir. Dışarı çıkan gazla dolu bir test tüpüne parlayan bir splintin uygulanmasıyla ortaya çıkan ayırt edici ses, hidrojenin oksijenle reaksiyonundan kaynaklanıyor. Test edilen tüm metaller arasında magnezyum en reaktif olanıdır ve bunu çinko, demir, nikel ve bakır takip etmektedir. Bunu söyleyebiliriz çünkü gaz kabarcıklarının yoğunluğu metalin aktivitesini gösterir. Bakır içeren tüplerde herhangi bir değişiklik gözlenmedi. Bu, bakırın hidrojeni hidroklorik asitten veya seyreltik sülfürik (VI) asitten çıkaramadığını gösterir.
